新型コロナウイルス感染症「第7波」の急拡大が全国的に続いている。そうした中で厚生労働省薬事・食品衛生審議会の医薬品第二部会と薬事分科会の合同会議が20日夜開かれた。この日の審議議題は塩野義製薬が開発した国内初の新型コロナ飲み薬である「ゾコーバ」の「緊急承認」を認めるかどうかだった。
2時間以上に及ぶ熱を帯びた議論の結果、審議を継続することになった。同社は臨床試験(治験)の最終結果を11月にも提出する予定で、改めて審議される。新開発の薬を速やかに使えるよう5月に創設された緊急承認制度の初適用は見送られ、国産初の軽症者向け飲み薬の実用化は実現しなかった。
海外飲み薬は投与しにくく
身近なクリニックで診断・処方でき、自宅でも服用できる軽症者向けの新型コロナ飲み薬は、治療の遅れによって重症になる患者を減らして医療現場の負担も軽減できる。厳しい行動制限をせずに日常生活に戻るための鍵になるとも期待されていた。現在、軽症者にも使える飲み薬としては米製薬大手メルクの「モルヌピラビル」と同ファイザーの「パキロビッド」が「特例承認」されている。特例承認は海外での治験データを前提に、国内治験データも加味して承認する制度だ。
モルヌピラビルはウイルスの設計図であるRNAの複製を妨げる働きがある。パキロビッドはウイルスが体内で増殖するのを防ぐ効果が期待される。いずれも抗ウイルス薬だ。だが、2剤とも外国製で調達量に一定の制限があり、適用の対象は重症化リスクがある高齢者や基礎疾患がある患者だ。


パキロビッドは高血圧や脂質異常症の薬など「併用禁忌」の薬が30種以上もあるという問題もあった。このほか軽症者向け治療薬としては英製薬大手グラクソ・スミスクラインなどが開発した「ソトロビマブ」があるが、点滴で投薬する必要がある。
モルヌピラビルは長径2センチ以上あり、高齢者は飲みにくいという指摘もある。政府は約160万人分を確保したが、厚労省などによると、投与されたのは7月中旬時点で約23万人。政府はパキロビッドも約200万人分を確保したが、高齢者中心の投与者の多くは併用禁忌薬も飲んでいることから投与者はわずか約1.5万人にとどまるという。
承認を前提に100万人分を基本合意
こうした中で開発が進んでいた塩野義製薬のゾコーバは国内産で手軽に服用できる飲み薬として政府内部のほか、臨床医や感染症の専門家の間でも実用化への期待は大きかった。薬は動物実験や「第Ⅰ相」「第Ⅱ相」「第Ⅲ相」の3段階の臨床試験データを厳密に審査し、安全性や効果が確認されて初めて承認される。
医薬品の審査は多くの場合1年程度かかる。新型コロナの国内拡大が続いて対応を迫られた政府は海外で開発され、先行して流通している医薬品を対象に審査を簡略化できる特例承認の制度を用いて新しい薬やワクチンを承認してきた。しかしこの制度でも国産の新薬は対象外で、ワクチンの承認では欧米より承認が2~5カ月程度遅れた。
このため政府は新たな制度を急いだ。それが緊急時にワクチンや治療薬などを速やかに薬事承認する緊急承認制度だ。5月13日に同制度の新設を盛り込んだ改正医薬品医療機器法が国会で成立した。
この制度は、国民の生命に重大な影響を及ぼす恐れがある病気のまん延を防ぐことが目的で、治験完了前の中間段階でも安全性が確認され、臨床上意義のある評価指標で有効性が「推定」できれば実用化を認める、としている。感染状況を踏まえた緊急性も考慮される。
塩野義製薬は今年2月に国内初の軽症者向け飲み薬としてゾコーバの承認を厚労省に申請。その際は比較的迅速な審査が期待できる「条件付き早期承認制度」の適用を要望した。しかし、同制度は希少疾患などの患者数が少ない医薬品を対象としているため、緊急承認制度が成立した後の5月下旬にこの制度の適用を申請した。政府はゾコーバの実用化に期待し、承認を前提に塩野義製薬と100万人分購入の基本合意をしている。

治験の初期段階の評価は微妙
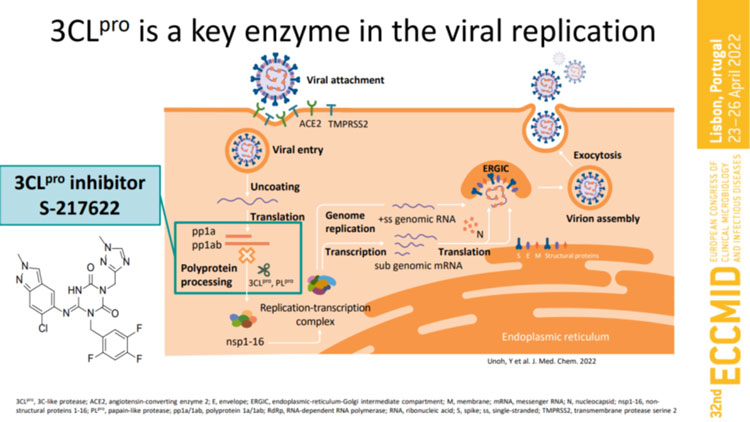
ゾコーバは塩野義製薬が北海道大学と共同で開発した低分子の経口薬、つまり飲み薬で開発番号は「S-217622」。この新薬は新型コロナウイルスが増殖する時に必要な「3CLプロテアーゼ」という酵素を選択的に阻害し、ウイルスの増殖を防ぐとされる。
同社は2月7日に治験の第Ⅱ相のうち69例を対象にした「2a」の、その後428例を対象にした「2b」のそれぞれデータを公表している。「速報」とも言える69例データでは、投与4日目(3回投与)後のウイルス量(力価)は偽薬と比べ(投与用量などにより)60~80%減少。臨床症状も改善が見られ、一方重篤な副反応はなかったという。
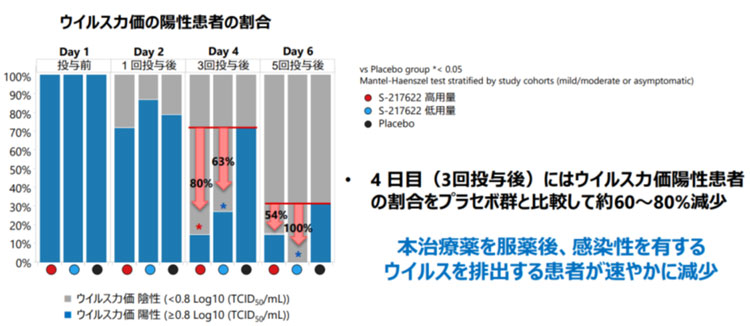
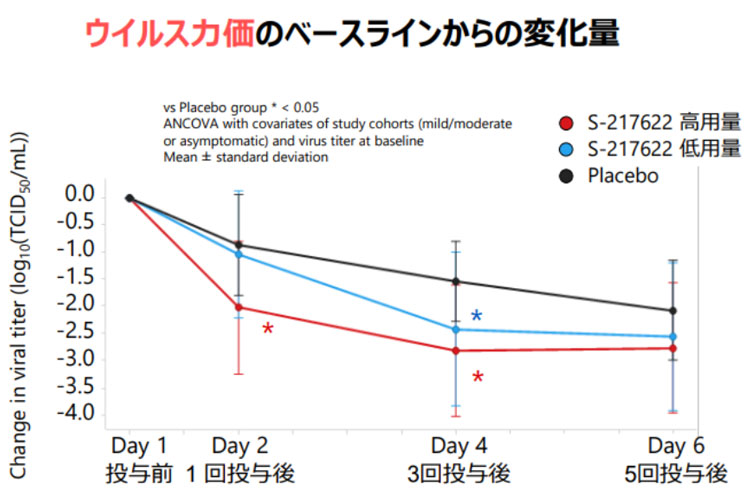
公表データによると、第Ⅱ相「2b」は軽症・中等症の428例(日本人419例、韓国人9例)が対象。428人を低用量投与、高用量投与、偽薬(プラセボ)投与の3群に分け、1日1回、5日間投与した。その結果は、低用量と高用量の2群は偽薬群と比べウイルス力価は有意に減少した。
臨床効果について症状をスコアにしたところ、初回投与から120時間(6日目)までの変化量はゾコーバの2群は偽薬群と比べに減少したが、「統計学的有意」な差までには至らなかった。この中で鼻水、喉の痛み、咳、息切れという呼吸器症状だけでは有意差があった。しかし12症状改善の総合評価では偽薬群と比べ明確な差は出せなかった。治験の初期段階の評価としては微妙だった。
「『BA.5』にも効果」と塩野義製薬
7月に入り、国内のではオミクロン株の派生型の「BA.2」から感染力が約1.3倍強いとされる「BA.5」への置き換わりが進んだ。国立感染症研究所によると、8月第1週にはほぼ全てBA.5に置き換わる見通しだ。
塩野義製薬は14日に「ゾコーバはBA.4やBA.5に対しても高い抗ウイルス活性を確認した」と発表した。細胞レベル(イン・ビトロ)での試験データで、同社は「繰り返される変異株に対しても速やかに評価を実施して公衆衛生上有益な情報を提供する」などとコメントした。
ゾコーバの緊急承認を巡る審議は6月22日の医薬品第二部会の会合で有効性の評価で賛否両方の意見が出てまとまらず一度継続審議になっている。その後、第7波が急拡大。7月20日に広く審議結果が注目される中、公開で行われた。
審議会合で賛否の意見2分
20日午後6時から始まった合同会義にはオンライン参加も含め30人以上が参加した。まず、医薬品医療機器総合機構(PMDA)代表が審査報告書の内容を説明した。「ウイルス量が減少する傾向が認められることは否定しないが、効能・効果に対する有効性が推定できるとは判断できず、第Ⅲ相の結果を踏まえて改めて検討する必要がある」「社会的観点からより早期に使用可能とする検討も可能と考える」。相いれないような2つの評価の併記に審査の難しさが読み取れた。
審議で3人の参考人はいずれも示されたデータでも緊急承認の要件である「有効性の推定」はできる、などと指摘。「新設された緊急承認制度の意義を考えると早期診断や早期治療に有効」「既存の2剤に使用制限がある中で治療の選択肢が増えることは有益」などと発言した。症状改善の効果が明確にならなかった理由として「臨床試験中に(流行株が)デルタ株から(軽症者が多い)オミクロン株に代わり症状が大きく変化したことも影響した」との解説も聞かれた。
しかし、参加した委員からは緊急承認に反対や慎重な意見が相次いだ。「動物実験では胎児に影響する催奇形性リスクが示されている」「(私は)示されたデータからは有効性を推定できない」「低用量と高用量で反応にあまり差がないのはおかしいのでは」「ゾコーバも一緒に使えない薬が多くある」などだ。動物実験での催奇形性を挙げた反対意見に対し、承認済みの外国製飲み薬にも同じような報告があることを指摘する意見が出るなど、議論は熱を帯びた。
「評価対象の症状の中でも発熱や呼吸器症状への効果はあるようだ」として感染者が急増する中で新たな治療手段につながる緊急承認に前向きな声は聞かれたものの反対、慎重な意見の方が多かった印象だ。意見は多様だったが議論の流れは「第Ⅲ相の結果まで待つべきだ」に傾いた。
最後は薬事分科会の太田茂会長が「データから有効性は推定されないとの意見が多くを占めた。(現在進んでいる)第Ⅲ相の結果を待って改めて審議したい」と締めくくって継続審議が決まった。
治療の決め手なく、医療現場から不安や戸惑いも
第7波の猛威は凄まじく、ゾコーバの緊急承認が見送られた翌21日。全国の新規感染者は、3万人を超えた東京都をはじめ多くの県で過去最多を記録し、総計では18万人を超えた。
使用上の制限が比較的少ないとされるゾコーバは多くの臨床医のほか、政府や保健行政の関係者からは期待されていた。政府部内ではPMDAの審査報告書に「社会的観点からより早期に使用可能とする検討も可能」との表現があることから第7波の急拡大の現実を考慮されて緊急承認される、との楽観的見方が多かった。厚労省からは後藤茂之厚労相が緊急承認後の記者対応を準備していたとの話も伝わった。
医療現場でも審議会での議論と同じように、早期承認を待ち望む声と慎重な意見が入り交じる。「詳しいデータが論文などで出ないと現場で使えるか判断がつかない」と明言する意見がある。
その一方で連日大勢の感染者を診断、診療している現場の医師からは「治療の決め手がない現在、審議継続には正直がっかりした」「示されたデータから私は使用できると考えていた。何のための緊急承認の枠組みを作ったのか」といった戸惑いや今後の診断、診療に不安を訴える声も少なくない。
審議会会合の議論ではゾコーバの効果評価で一致できなかった。治験の最終結果を待つべきとの結論は説得力がある。ゾコーバは承認されれば多くの人が服用すると見込まれるだけに、慎重な判断と審議継続の結論は妥当と言うべきだろう。
政府、いまだ「出口戦略」を描けず
審議から離れて現在のコロナ禍の現実に目を向ける。
想定を超える第7波の急拡大を受けて医療現場は再び逼迫(ひっぱく)しつつある。PCR検査も依然「いつでも誰でも受けられる」体制は整っていない。自宅で簡単に感染の有無をチェックできる抗原検査キットも入手しにくい。
ゾコーバの緊急承認は見送られた。医療現場は依然治療の「切り札」を見いだせないまま患者対応に奮闘している。政府はコロナ禍の収束をいまだ見通せず、「出口戦略」を描けないでいる。





