厚生労働省が10日、米製薬大手ファイザーが開発した新型コロナウイルス感染症の飲み薬「パキロビッド」を特例承認した。軽症者が使える飲み薬としては、昨年12月末に特例承認され、既に使用されている米製薬大手メルクの「モルヌピラビル」に次いで2例目。日本の塩野義製薬も近く承認申請する予定だ。政府は供給量を見通せるこの国産の飲み薬も早期に承認したい考えだ。承認されれば軽症の感染者も服用できる3種類の飲み薬がそろい、軽症や中等症患者の治療の選択肢は増え、重症患者の軽減への効果が期待される。

厚労省によると、新型コロナによる死者数が11日に累計で2万人を超えた。年が明けると感染力が強いオミクロン株による感染が急拡大し、2月3日には全国の新規感染者が10万人を突破。死者数は高齢者を中心に100人台になる日が続いていた。こうした流行の「第6波」を迎えて、国内の累計感染者は11日現在約380万人。全体の致死率は0.5%程度だが、高齢になるほど死者が増える傾向がある。
このため政府は「全体では重症化率が低い」とされるオミクロン株感染者を軽症、中等症の段階で治療できる飲み薬の国内実用化と普及を、ワクチン3回目接種の進ちょくとともに感染拡大防止対策の柱にしている。
「飲み合わせ」や供給量に課題も
厚労省によると、パキロビッドは体内で新型コロナウイルスが増殖するのを防ぐ「抗ウイルス薬」に分類される。ウイルスに必要なタンパク質の合成を阻害する働きがある主剤の「ニルマトレルビル」と、抗エイズウイルス(HIV)薬としても使用され、主剤の分解を遅らせて血中濃度を保つ「リトナビル」の2剤で構成される。軽症や中等症と診断され、基礎疾患があり、高齢など、重症化リスクのある患者が主な対象で、1日2回、5日間服用する。
パキロビッドはウイルスの設計図であるRNAの複製を妨げるモルヌピラビルとは異なる仕組みだ。臨床試験(治験)データでは、入院や死亡のリスクは発症3日以内投与で89%、同5日以内投与で88%減少したという。臨床医からは点滴で使う抗体医薬と同じぐらい効果が高い、との指摘も聞かれ期待は高まっている。これまでのデータでオミクロン株にも効果があるとされる。
その一方で、高血圧や脂質異常症の薬など「併用禁忌」の薬が30種類以上もあり、この他「併用注意」の薬も多い。新型コロナ以外の病気でさまざまな薬を飲んでいると使えない場合があるのだ。高齢者は高血圧の人が多く、脂質異常の人も多いので特に注意が必要だ。

特例承認に際しては、医師や薬剤師がパキロビッドを処方する際には患者が使っている全ての薬を確認することが前提とされた。このため厚労省は当面、適切に薬を扱えると考えられる全国約2000の医療機関での院内処方に限定。得られた注意点や改善点を踏まえた上で他の医療機関や薬局へと広げる方針だ。
供給量の確保も課題だ。政府はファイザーと200万人分の確保で合意した、としているが期限は年内で、既に輸入された量は約4万人分にとどまるという。米国では昨年12月に先行して実用化している。バイデン米大統領は1月の演説で、米国は世界のどこよりも多く確保したと強調しているが、米国からの報道では需要が供給に追い付かないという。モルヌピラビルの入院や死亡のリスク低減効果は30%とされている。単純には比較できないが、有効性を示す数値だけを見るとパキロビッドの方が高い。
ファイザーが2月10日に公表したプレスリリースによると、2022年中の製造可能量を当初の8000万人分から1億2000万人分に増やし、100以上の国と調達契約協議中だ。欧米でもパキロビッドへの期待は大きく、各国で“取り合い”になることも予想されている。
国産の塩野義は月内にも承認申請へ
塩野義製薬によると、同社は軽症や中等症の患者を想定した飲み薬を月内にも承認申請するという。塩野義が北海道大学と共同で開発した飲み薬はまだ名前が付いていないが、開発番号は「S-217622」。パキロビッド同様、体内でウイルスが増えるのを防ぐ抗ウイルス薬だ。昨年9月に約2000人を対象にした最終段階の治験を開始し、2月7日にこの結果の一部を公表した。
公表によると、69人の治療効果を解析したところ、1日1回、5日間経口投与した人は偽薬を服用した人と比べてウイルス量を減らす効果が確認できたという。塩野義製薬の手代木功社長は7日に記者会見して月内に承認申請する可能性があることを明らかにした。同社長は2月末に40万~50万人、3月末までに100万人分程度の提供が可能との見通しを示している。
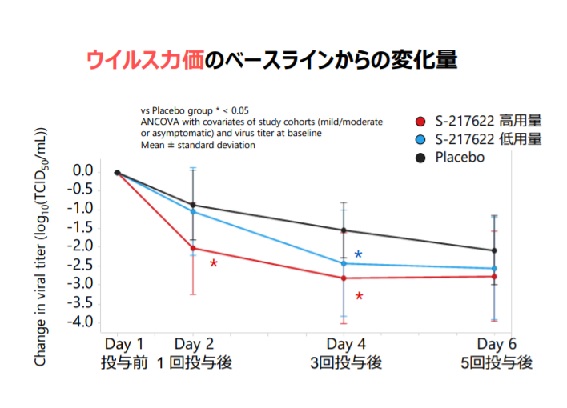
承認申請は早期の実用化が可能な「条件付き早期承認制度」の適用を求めるとみられる。同制度は、有効な治療法が少ない病気の医薬品が対象になる。患者数が少なく治験の実施に長い期間が要する場合などに一定程度の有効性や安全性が確認できれば、最終段階の治験を行わずに早期に承認申請できる仕組みだ。
岸田文雄首相は7日の衆院予算委員会で、塩野義の開発薬と条件付き早期承認制度を念頭に置いた国産飲み薬の実用化について「あらゆる手法の活用を視野に迅速に審査を行う」と述べている。経済安全保障の観点から政府が国産の治療薬に対する期待は高いが、承認に際しては有効性や安全性について、きちんとした評価結果が示されなければならない。
迅速な検査・診断体制が前提、適切、的確な運用の仕組みを
現在の感染拡大の「第6波」はオミクロン株のまん延による。それだけに飲み薬もオミクロン株への効果が気になるところだ。メルクは1月28日、「欧米6カ国で実施した細胞培養実験結果から、モルヌピラビルがオミクロン株に効く可能性を示す研究結果が得られた」と発表している。
この他、東京大学医科学研究所の研究グループもやはり、細胞培養実験でモルヌピラビルの効果が期待できる、との研究データを1月下旬に米医学誌に発表している。患者に飲んでもらい効果を検証する研究ではなかったが、治療効果への期待は大きい。
厚労省はメルク側とモルヌピラビル約160万人分の供給契約を結んでいる。詳しい量は不明だが、既に一定程度が多くの医療現場や薬局に渡っている。特例承認されたファイザーのパキロビッドも来月以降、国内の医療現場に普及する見通しだ。ただ2剤とも個々の医療現場や薬局への供給量は月単位で制限がある。

こうした飲み薬は、これまで医師による点滴や注射での投与が必要だった医療現場の負担軽減につながる。特例承認された2剤はいずれも「発症5日以内」に投与されなければならない。発熱などの症状が出た場合、速やかに診断されないと間に合わない。つまり迅速な検査・診断体制が前提となる。だが、新規感染者が多い現在、検査キットは不足気味だ。第6波による重症者や死亡者数を減らすためにも、検査体制の拡充とセットの適切、的確な運用の仕組みが極めて重要になる。
関連リンク
- 厚生労働省プレスリリース「新型コロナウイルス治療薬の特例承認について」
- 米ファイザー・プレスリリース欄
- 米メルク・プレスリリース欄
- 塩野義製薬・ニュース欄




