厚生労働省の薬事・食品衛生審議会医薬品第1部会は21日、製薬大手エーザイと米バイオジェンが共同開発したアルツハイマー病の治療新薬「レカネマブ(商品名レケンビ)」の製造販売承認を了承した。レカネマブは病気を発症させる原因タンパク質「アミロイドベータ」の物質を除去して進行を遅らせる効果が期待される初の認知症薬。厚労相が正式承認する見込みで早ければ年内にも実用化される。
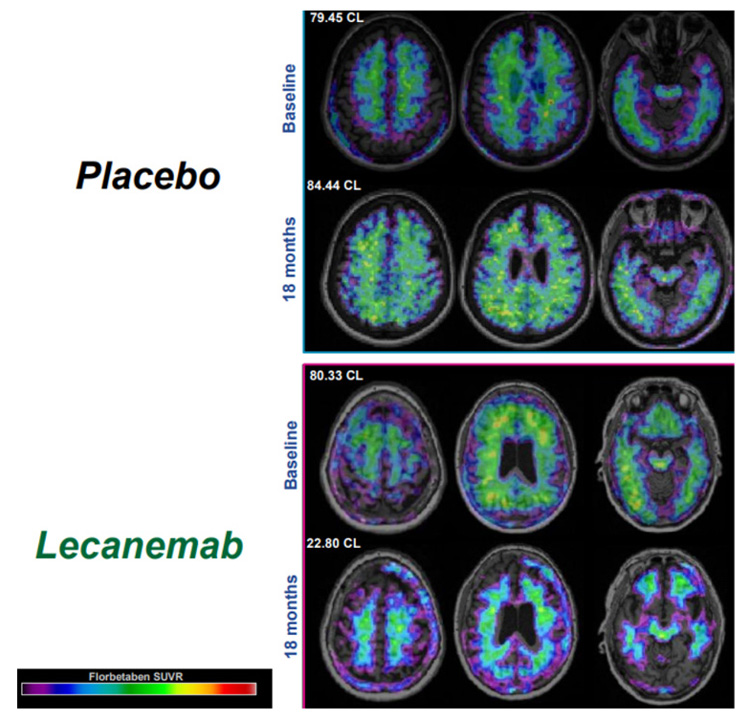
レカネマブは、患者の脳内に蓄積し、神経細胞を壊すとされるアミロイドベータの除去を目的とする新しいタイプの薬。アミロイドベータが固まる前の段階で人工的につくった抗体を結合させて神経細胞が壊れるのを防ぐ仕組みだ。このタイプは病気の原因に直接働きかける「疾患修飾薬」と呼ばれる。ただし、既に死んでしまった神経細胞は再生できないため、投薬効果が期待できるのは発病早期の患者に限られる。このため投与対象はアミロイドベータが脳内に蓄積し、生活に支障が出始めた軽度の患者とその前段階の軽度認知障害(MCI)の人。

エーザイとバイオジェンは、日本や米国のほか欧州、アジアの235医療機関で早期のアルツハイマー病と診断された患者1795人(平均年齢72歳、男女ほぼ半々)を対象に、新薬レカネマブを体重に応じた量を2週間に1回点滴する臨床試験を実施した。両社によると、18カ月後に症状の悪化を偽薬(プラセボ)投与群と比べた。その結果、新薬投与群は記憶や判断力などの認知機能や身体活動などに出る症状の悪化が27%抑制された。
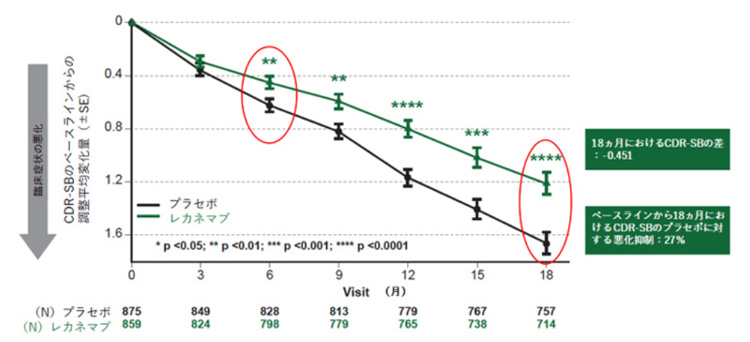
臨床試験の結果を受けてエーザイとバイオジェンは今年1月16日に厚労省に製造販売承認を申請した。同省の医薬品第1部会は8月21日、午後6時から約3時間以上にわたり審議。審議は非公開で行われたが同省関係者によると、症状の進行を遅らせる効果が認められた。申請にあった脳のむくみや出血などの副作用についても安全性に重大な懸念はないとされたが、投与前に出血傾向の有無を調べることや血栓を溶かす薬を服用している人への注意喚起が付いた。
アルツハイマー病は脳の神経細胞の働きが弱くなって認知機能が低下する進行性の病気で、問診や脳画像、脳脊髄液の検査などを行って診断する。厚労省によると、この病気は認知症全体の70%近くを占める。認知症を患う高齢者数は2025年には約700万人、65歳以上の約5人に1人にも上るとの試算がある。
米食品医薬品局(FDA)は1月に迅速承認して米国内での販売が始まっていた。7月6日には本承認された。米ワシントンからの報道によると、特定の遺伝子「APOE4」を持つ人は副作用リスクが増すとして、使用前に遺伝子検査をすべきとする注意事項が付いた。

バイオジェンは過去、エーザイと共同開発した似た働きの「アデュカヌマブ」を申請したが、厚労省の医薬品第1部会は21年、薬の有効性を明確に判断するのは難しいと判断し承認を見送った経緯があり、両社として社運をかけたレカネマブの承認申請だった。
アルツハイマー病の治療を巡ってはエーザイが1999年に世界初の治療薬「アリセプト」を日本で発売して以降、現在使われている治療薬は4種類。脳の神経伝達物質量を増やすなどの効果があり、一時的に症状は改善するとされていたが、効果は限定的だった。こうした中で、厚労省が来月にも承認するとみられるレカネマブは軽症患者や家族、医療関係者らの期待は大きい。
一方、臨床試験では投与後は深刻ではないものの一定の割合で副作用が出ていることから副作用の有無を定期的に調べる検査も必要だが、適切に対応できる医療機関は限られる。国民病とも言えるアルツハイマー病に対する新薬に対しては社会の期待も大きいだけに、実用化に当たっては早期受診や副作用検査がきちんとできる医療体制の整備が必要になる。
レカネマブのような抗体医薬は高額になる。米国では1人当たり年間2万6500ドル(約380万円)かかり、高齢者向けの保険適用も決まったと伝えられる。日本では今後厚労相の諮問機関である中央社会保険医療協議会が薬価を決める予定だ。かなりの高額になるとみられるが、政府も社会的要請を考慮し、自己負担額が一定額に抑えられる「高額療養費制度」が適用される可能性が高い。
◇8月23日追記
本文の一部を訂正しました。
7段落目
誤「エーザイは過去、似た働きの「アデュカヌマブ」を申請したが~」
正「バイオジェンは過去、エーザイと共同開発した似た働きの「アデュカヌマブ」を申請したが~」
誤「~同社として社運をかけたレカネマブの承認申請だった。」
正「~両社として社運をかけたレカネマブの承認申請だった。」




