スーパーコンピューター「富岳」などを活用し、新型コロナウイルス(SRAS-CoV-2)表面にあって感染に重要な働きをするスパイクタンパク質の構造変化のメカニズムを解明した、と理化学研究所(理研)の研究グループが発表した。同タンパク質上にある糖鎖の役割を突き止めたことがポイントで、感染予防や治療に向けた新しい医薬品の開発研究に貢献できるという。
研究グループが活用したスパコンは富岳と、東京大学と筑波大学が共同運営する「Oakforest-PACS」。理研計算科学研究センター粒子系生物物理研究チームの杉田有治チームリーダーらは、2つのスパコンでSRAS-CoV-2のスパイクタンパク質の分子動力学的なシミュレーションを実施した。

研究グループなどによると、SRAS-CoV-2は表面にあるスパイクタンパク質が人の細胞表面の「ACE2受容体」に結合、吸着して細胞内に侵入する。この過程が感染初期段階の最重要過程だ。このタンパク質の立体構造は特殊な電子顕微鏡により明らかにされているが、常に動いて構造は少しずつ変化する。
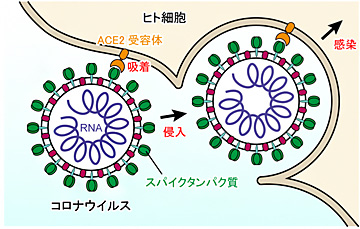
これまでの研究でスパイクタンパク質はダウン型、アップ型と呼ばれる2つの構造をとり、人のACE2受容体と結合していない時は2つの構造を行き来しているが、結合して感染する時はアップ型の構造になって安定することが分かってきた。また、スパイクタンパク質表面の多くのアミノ酸が、単糖が長く連なった糖鎖によって「修飾」されていることも判明している。修飾とは、タンパク質が化学的に構造や機能に影響を受けることで、糖鎖修飾は医薬品開発などに利用される。
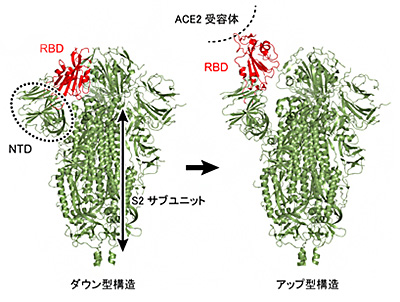
このようにスパイクタンパク質上の糖鎖が感染過程で重要な存在であるとみられることが明らかになって多くの研究者が注目していた。しかしこの糖鎖の分子構造やウイルス感染時の役割は分かっていなかった。
シミュレーションの結果、スパイクタンパク質表面の165番目、234番目、343番目の3つのアミノ酸(アスパラギン)をそれぞれ修飾する糖鎖が受容体結合部分の構造に大きく影響を与えていることが分かった。また、ダウン型構造では3つの受容体結合部分の境界面が広い範囲で正に帯電しており、静電的な反発などによってアップ型への構造変化が起きることも判明したという。
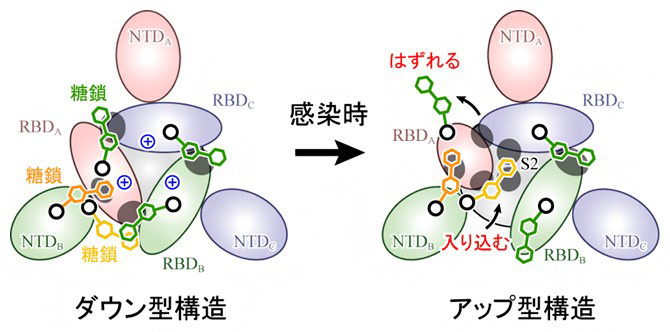
新型コロナ感染症の治療薬などを開発するためには、ウイルス感染の詳細なメカニズムを解明する必要がある。今回の成果について研究グループは、SRAS-CoV-2の感染に関わる分子レベルのメカニズムを解明したことになる、としている。
スパイクタンパク質の構造変化で重要な役割を担うことが明らかになった糖鎖に着目し、このタンパク質とACE2受容体との結合を阻害する方法などを見つければ、新たな医薬品の開発につながると期待される。
研究グループは杉田チームリーダーのほか、同チームの小林千草技師、理研開拓研究本部杉田理論分子科学研究室の森貴治専任研究員、ジョン・ジェウン専任技師らで構成。研究成果は2月13日付の米科学誌「バイオフィジカル・ジャーナル」電子版に掲載された。
関連リンク
- 理化学研究所プレスリリース「新型コロナウイルス感染の分子機構を解明-医薬品の分子設計に貢献する「富岳」による新しい知見-」




