
2009年に起こった新型インフルエンザウイルスの世界的流行、パンデミック。アフリカで猛威をふるうエボラウイルス。ウイルス感染症は今なお、人類の生存を脅かす最大の脅威だ。
科学技術はウイルスをどう理解し、その脅威と戦おうとしているのか。今年3月に発表されたインフルエンザウイルス”Color-flu(カラフル)”、そして新しいエボラウイルスワクチン、さらに話題のLabミッション”Save the World!”まで、ウイルス学者の河岡義裕(かわおか よしひろ)東京大学医科学研究所教授に聞いた。
サイエンスニュース2015「ウイルスの制圧を目指す リバースジェネティクス(2015年6月3日配信)」より
―インフルエンザウイルスの動態と、先生のグループが開発された蛍光タンパク質を発現するインフルエンザウイルス「Color-flu(カラフル)」の意義について伺います。
インフルエンザウイルスのターゲットオーガン(標的器官)は呼吸器です。ウイルスが鼻・喉・肺といったところで増殖することによってサイトカイン(細胞間情報伝達分子となる微量生理活性タンパク質)が出て、それが発熱や関節痛などにつながります。ウイルスが、例えば関節痛などといった痛みの部位で増えているのではありません。ただ、一部の特殊な高病原性の鳥インフルエンザウイルスなどは呼吸器以外の臓器、時には脳で増えることもあります。
インフルエンザウイルスの場合は、リアソートメント(遺伝子再集合)といって、異なるウイルスが同時に感染することで新種のウイルスが出現する現象があり、これがパンデミックを引き起こす原因だと考えられています。この現象では、体の中でどのようにして起きるかというメカニズムがほとんど解明されていません。今回、色の違うウイルスを作ったことで、体の中で異なるウイルスがどのようにして混ざり合って新型ウイルスを出現させるのか、メカニズムの解明とその治療方法やワクチン開発に役立つことを期待しています。
―「Color-flu(カラフル)」を今後、他の研究機関などに提供する予定はありますか。
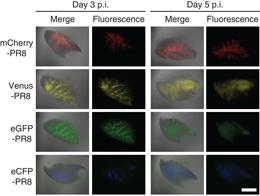
©Nature Communications 6 : 6600 doi: 10.1038/ncomms7600 (2015)
ウイルスに感染した細胞を安定的に追いかける技術は初ということで、特に免疫分野の研究者に非常に興味を持っていただいており、このウイルスが欲しいという要望が結構あります。
ウイルスを人工的に合成
―1999年に発表されたリバースジェネティクスとその開発の経緯についてお教えください。例えば、京都大学の山中伸弥(やまなか しんや)先生は米国の研究チームと競い合ったとされていますが。
リバースジェネティクスというのは、プラスミド(細菌の核外などに存在して細胞分裂によって娘細胞へ引き継がれるDNA分子の総称)からウイルスを自由自在に作るという方法です。この技術を使うことによって今回のような蛍光タンパク質の遺伝子を入れたり、それ以外の変異を入れたりすることが自由にできます。
この技術開発は分野としては皆がやろうとしていました。この開発に成功した1999年当時は、われわれの研究チームの目的ではなかったのですが、たまたま他の研究をしているときに成功したのです。「これならできるのではないか」という成績が出て、やってみたらできたという感じでした。
―昨年から今年にかけて西アフリカでエボラ出血熱が猛威を振るっていることで、治療薬やワクチンの研究が世界的に盛んだという情報が飛び交っています。河岡先生のワクチンは、その中でもどういったところが大きな違い、ポイントになるでしょうか。
©CDC Global
今ヒトで臨床試験が行われているエボラウイルスワクチンは基本的に3つありますが、いずれの場合も他のウイルスにエボラウイルスの遺伝子を載せて「生きたウイルス」を感染(接種)させています。その効果は非常に高いのですが、副反応(副作用)の問題があります。例えば、生の水胞性口炎ウイルスにエボラウイルスの遺伝子を入れた生ワクチンでは、臨床試験で副反応が出て関節炎になった方や「エボラと変わらないくらいの発熱だ!」と言っている方もいらっしゃったそうです。
こういった観点から、安全性の高いワクチンが非常に重要です。われわれの新しいワクチンは不活化ワクチン、つまり殺したウイルスなので、安全性は生ワクチンよりも高いと考えています。
―ワクチン開発の経緯、特にバイオセーフティレベル(BSL)との関係についてお聞かせください。
まず、エボラウイルスをプラスミドから人工的に作るという技術を開発しました。エボラウイルスというのは、最も危険度の高い微生物・病原体を実験できるBSL-4の施設がないと扱えないウイルスなので、 BSL-4がなくても実験できるウイルスを作ろうと思ったのです。
エボラウイルスの増殖に欠かせないVP30タンパク質を欠損させた変異ウイルスは、普通の細胞や動物では全く増えないのに、VP30タンパク質を人工的に発現させた細胞では増殖します。われわれはBiologically Contained Virusと呼んでいますが、これによってBSL-4がなくてもBSL-3でその変異させたウイルスを増やすことができます。
作出した変異ウイルスは既にワクチンとして使えるのですが、普通の細胞では増殖しないといってもヒトにはなかなか使えません。安全性を考えて、さらに不活化したことで今回のワクチンができたわけです。

(サイエンスニュース事務局 寿桜子)
(続く)

河岡 義裕(かわおか よしひろ) 氏プロフィール:
1978年北海道大学獣医学部卒、80年鳥取大学農学部獣医微生物学講座助手、83年米セント・ジュード小児研究病院ポスドク研究員、85年同病院助教授研究員、89年准教授研究員、96年教授研究員、97年ウイスコンシン大学獣医学部教授、99年から現職。2008年から新型インフルエンザが宿主内でどのように強い病原性を獲得するかを解明するJSTの戦略的創造研究推進事業ERATO型研究「河岡感染宿主応答ネットワークプロジェクト」の研究総括。インフルエンザウイルスを人工的に作り出す手法を開発した研究成果で、06年ロベルト・コッホ賞受賞。著書に「インフルエンザ危機」(集英社新書)。13年多くのノーベル賞受賞者を輩出する米国科学アカデミーの外国人会員に選出されている。




