狂牛病やヒトのクロイツフェルト・ヤコブ病(CJD)など、いわゆるプリオン病の原因物質として知られる病原体プリオンについて、オリゴアデニル酸合成酵素(Oas1a、オーエーエスワンエー)という体内の酵素が抑制に関与していることを、福岡大学などの研究グループが明らかにした。プリオンは元々生体に存在するタンパク質で、プリオン病発症のメカニズムや免疫機構は詳しくは分かっていなかった。予防・治療薬の開発の手がかりになるという。
狂牛病として知られる牛海綿状脳症(BSE)や難病に指定されているCJDは、脳に異常プリオンと呼ばれるタンパク質が蓄積して発症するとされる。元々生体にあるプリオンには、正常プリオンと異常プリオンがある。これらは同じアミノ酸を持つが構造が異なり、後者が発病に関与する。
福岡大学薬学部免疫・分子治療学研究室の石橋大輔教授(分子生物学)らの研究グループは、プリオンがタンパク質主体で、細菌やウイルスのように獲得免疫を作れないことから、自然免疫に着目し、プリオン抑制への関与について調べてきた。
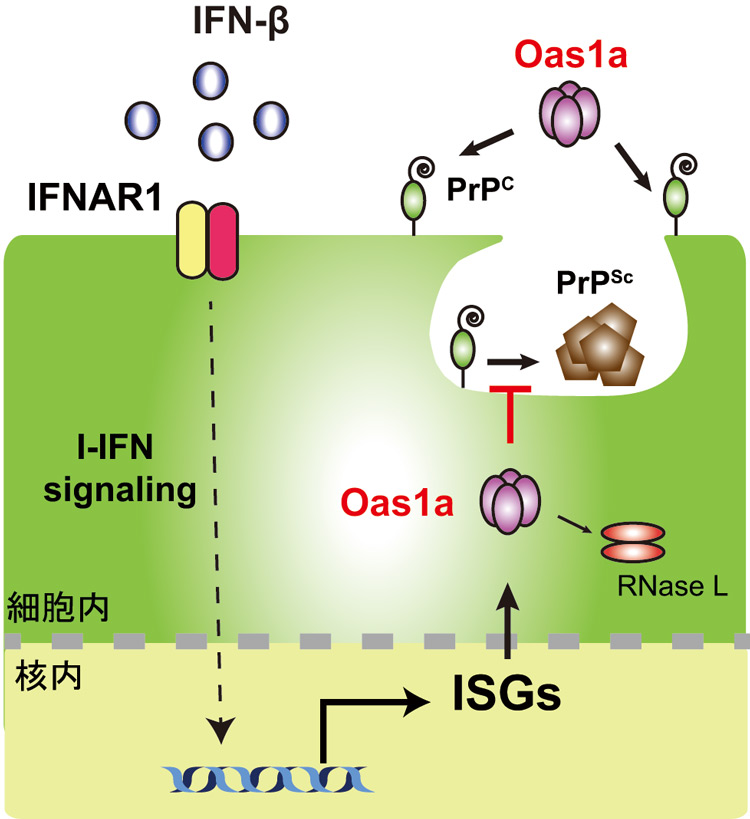
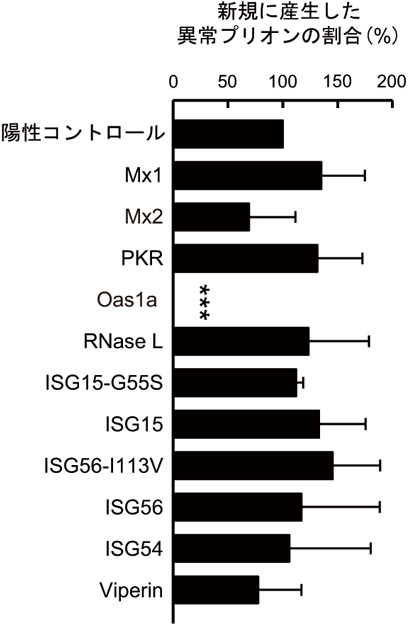
先行研究で、自然免疫のシステムに関わるI型インターフェロン(αおよびβ)がプリオンの感染を抑制することが明らかになっていた。しかし、同インターフェロンにより発現する遺伝子は300以上あるとされており、どの遺伝子が異常プリオンに働きかけるのかが分からなかった。そこで今回、同インターフェロンによって発現する遺伝子の異常プリオンに対する働きを調べた。その結果、Oas1aと呼ばれる酵素が何らかのカギを握っていることが分かった。
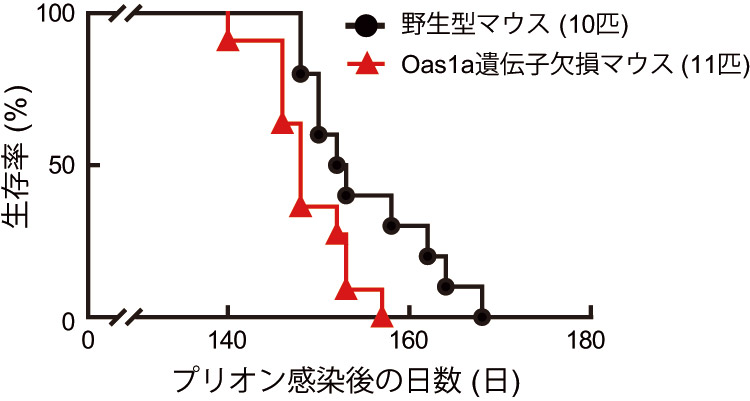
次に、Oas1aが産生できないようなマウスに、プリオンを感染させたところ、通常のマウスより早くプリオン病を発症した。さらに、Oas1aの作用機序を詳しく調べるために人工的に作製したOas1aを使い、プリオンの感染に対する影響を確認したところ、Oas1aが正常プリオンにくっつくことにより、異常プリオンになるのを防いでいた。
プリオン病はヒトの場合、多くは発症後約1~2年で死亡し、治療法や治療薬がない。患者は60歳以上に多く、100万人に1人が発症するとされる。献体で異常プリオンを調べると、死因は別の疾患であっても検出されることがある。なお、近年は北米のシカのプリオン病が問題となっており、その感染拡大から人獣共通感染症としてヒトへの感染が懸念される。
致死率の高さから疾患になるべく早く介入する対策が必要で、石橋教授は「今回の結果を基に予防・治療薬の開発につながればいい」としている。また、「Oas1aだけでなく、他のI型インターフェロンによって誘導される因子もプリオンの感染を防いでいるのではないか」との仮説を立てており、今後も続けて検証していくという。
研究は日本学術振興会科学研究費助成事業の助成を受け、大阪公立大学、長崎大学、東京大学、宮崎大学のグループと共同で行った。成果は英国の医科学誌「ブレイン」に5月23日に掲載され、同30日に福岡大学が発表した。
関連リンク
- 福岡大学プレスリリース「狂牛病で知られる病原体プリオンを抑制する生体内免疫機構を明らかに」




