赤血球や白血球、血小板になる造血幹細胞を再生医療で移植した際、幹細胞は血液の流れの刺激がきっかけとなって免疫細胞からの攻撃を回避し、長期にわたる再生能力を維持することを名古屋大学などのグループが明らかにした。薬剤など化学物質を使わなくても血管へ物理的刺激を与えると幹細胞や周りの免疫を制御することを示しており、再生医療への新たなアプローチになる可能性がある。
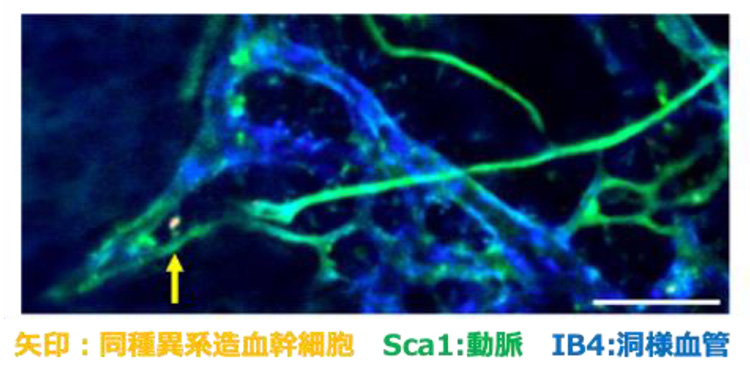
いろいろな細胞に分化する多能性をもつ幹細胞は、再生医療へ応用できる。ただ、実際に使用する幹細胞は、患者へ移植した後など必要な時に必要な分だけ増えて、それ以外の時は形質が変化しないよう再生能力を保ったまま、周りの免疫を刺激せず休眠状態を維持できることが求められる。
一方、動物の体内には、幹細胞が再生能力を維持したまま生息できる微小な環境(ニッチ)があるとされ、造血幹細胞では2000年ごろから骨の表面や特定の血管にニッチがあるという報告が続いている。
再生医学の研究を手がける名古屋大学大学院医学系研究科腎臓内科学の古橋和拡講師は間葉系幹細胞にある免疫制御分子「CD200」に目を付け、CD200を手がかりにすれば造血幹細胞を捉えてどのように免疫を制御しているかが分かると考えた。しかし、マウスの骨を顕微鏡で観察すると、幹細胞よりも骨の末端部にある細い血管が集まった毛細血管叢にCD200が多かった。
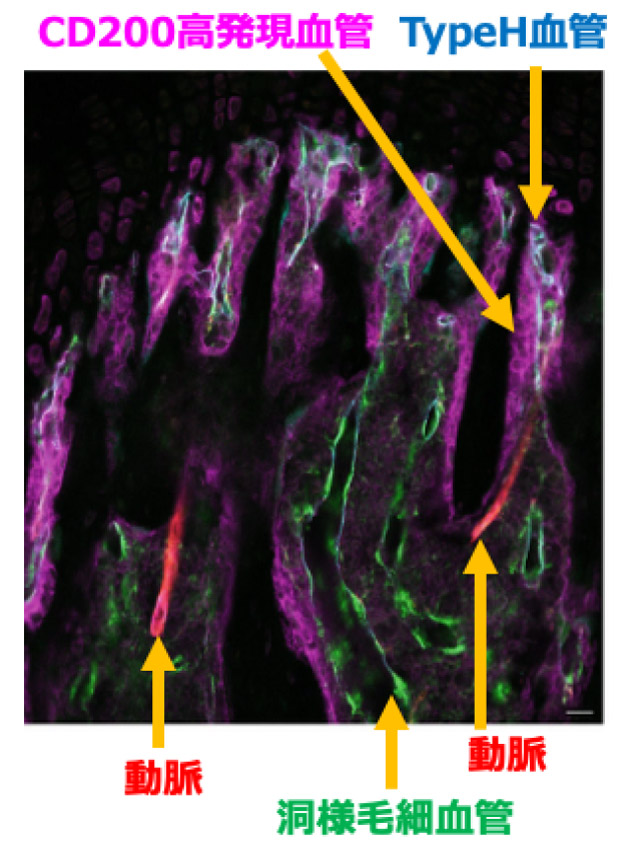
CD200が多くみられる毛細血管叢の部分では造血に関わるとされる一酸化窒素(NO)も多い。幹細胞にあるCD200の受容体を通じて、細胞内の酵素eNOSが活性化し、NOを産生する。CD200が多く見られる毛細血管叢の近くにある幹細胞を調べると、他の場所にある幹細胞よりNOが高濃度で含まれていることが分かった。
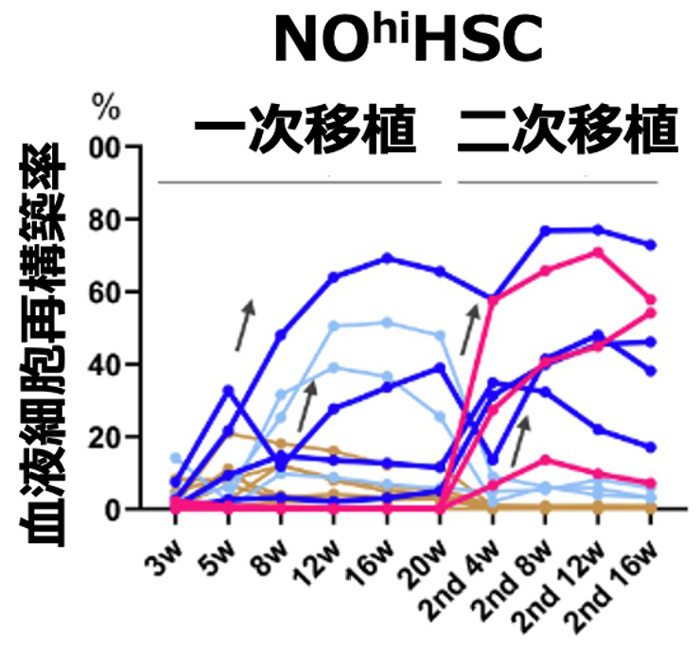
マウスにおいてNOを多く含む幹細胞を集めて骨髄移植をすると、NOをあまり含まない幹細胞より、欠損している血液細胞を効率良く再構成できた。中には休眠状態を経て2回目の移植で増殖する再生能力の高い幹細胞もあった。
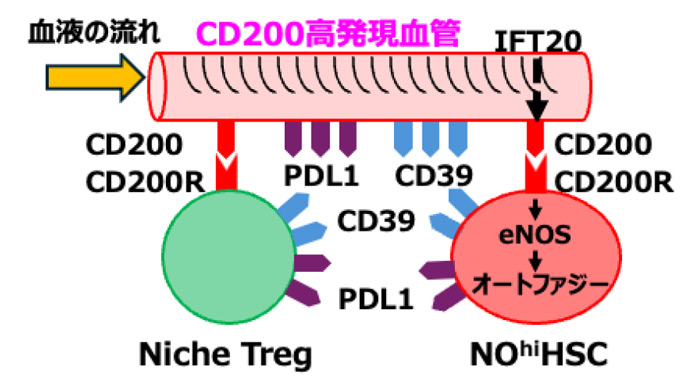
古橋講師らは、特定の遺伝子を機能しなくするノックアウトマウスなどを用いた実験で、血管の一次繊毛がセンサーの役目を果たして血液の流れを感知することや、免疫抑制分子CD200が血管内皮に発現すること、CD200のシグナルが幹細胞内に伝わって酵素eNOSが一酸化窒素NOを産生すること、NOは細胞内のオートファジーの自浄作用を促すことで幹細胞の再生能力維持に関わるらしいことなど、一連の流れを確認。幹細胞は血液の流れに制御されて再生能力を保ったまま休眠状態となり、免疫を逃れることを示した。
血液の流れの刺激が幹細胞の維持に関わっていることが明らかになったことから、古橋講師は「血管や血管周囲の細胞を制御することで組織幹細胞の制御から組織再生治療へ発展する知見が得られた。血管に囲まれているがん幹細胞を制御する新たな治療法の開発などにつながると期待できる」としている。
研究は、科学技術振興機構(JST)や偕行会医学基金、米国立衛生研究所(NIH)の支援を受け、米ハーバード大学の藤崎譲士准教授と同大の上田亮介博士研究員、米コロンビア大学の垣内美和子博士研究員らと共同で行い、論文が1月1日付け英科学誌ネイチャー電子版に掲載された。
関連リンク
- 大学プレスリリース「血液の流れが幹細胞を制御する」




