解熱剤などに用いられるアセトアミノフェンによる肝障害の治療薬物として、コエンザイムQ10を活性酸素の発生源となるミトコンドリアに直接送り届けるカプセルの開発に北海道大学の研究グループが成功した。カプセルをマウスに投与したところ、肝機能が回復していることが確認できた。臨床に応用できれば、肝障害の速やかな治療につながる。ミトコンドリアに直接アプローチする薬を多種多様に生み出せる可能性もあるという。
アセトアミノフェンは、コロナウイルスの流行によって一時品薄になるなど解熱・鎮痛薬として市販薬でも広く流通している。服用すると肝臓で毒性代謝物に変換されるが、通常はグルタチオンという抗酸化物質によって解毒される。ただ、長期服用によりグルタチオンが処理能力を超えると毒性代謝物がミトコンドリアに作用し、活性酸素を作って細胞死を誘発、肝臓に障害を引き起こす。
北大大学院薬学研究院の山田勇磨教授(薬剤学・薬物送達学)のグループは、肝障害の治療薬として従来のグルタチオンを補う方式ではなく、ミトコンドリアの活性酸素を作る働きを阻害するコエンザイムQ10を小さなカプセルにしてミトコンドリア内部に直に送り込むというアイデアを思いついた。

山田教授はミトコンドリアに作用させる薬剤の形態に関する研究を重ねてきた。ミトコンドリアは二重の膜でできており、特に内側の膜が電子でさえ通りづらい強固なつくりになっている。また、負に帯電しているミトコンドリアに、負の電荷を帯びた物質は届かない。山田教授は「カプセルの形状にして、やや正電荷でミトコンドリアの膜と一体化してなじむような性質を持たせたら良いのではないか」と考えた。
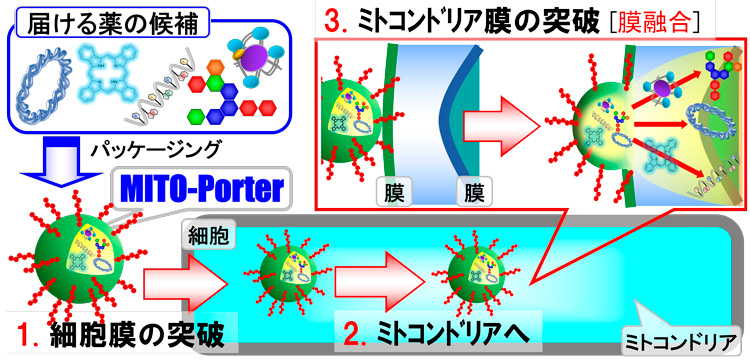
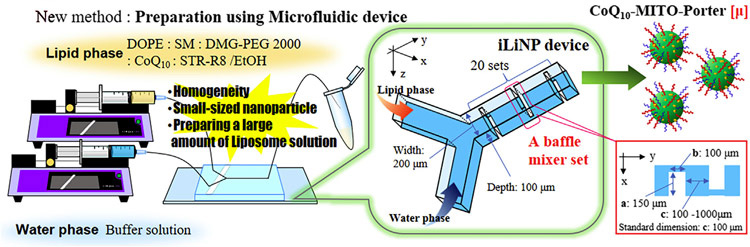
カプセルに投入するコエンザイムQ10は、脂溶性で水に溶けにくく、製剤にするにはミトコンドリアに吸収されやすい形態や大きさの工夫が必要となる。製剤の調製方法として、北大大学院工学研究院で開発された流体力学を生かして2つの物質を均一に混ぜ合わせるY字型のマイクロ流体デバイスを使用。Y字の一方にコエンザイムQ10とポリエチレングリコールを、他方に生理食塩水とリン酸緩衝液を混ぜた溶液を流し込むことで、50ナノメートル(ナノは10億分の1)のサイズの均一なカプセルを作製できた。
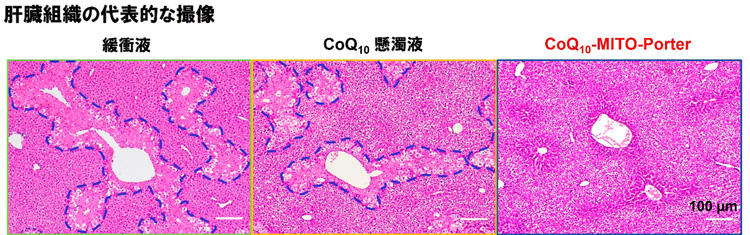
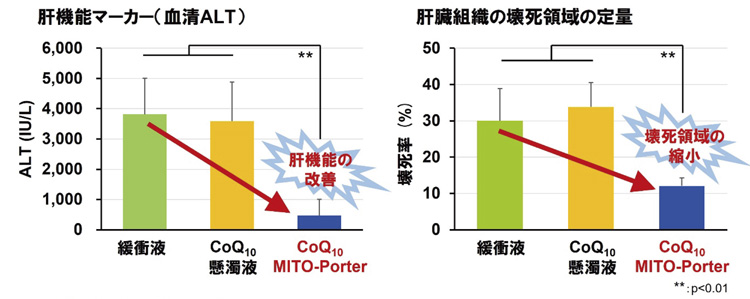
このコエンザイムQ10を閉じ込めたナノカプセルを、肝障害を起こしたマウスの尾の静脈から投与したところ、肝臓組織の壊死が縮小した。製剤として生体に吸収され治療効果を上げたことがわかった。また、マウスの体重1キログラムあたり0.9ミリグラムという少量でも効果があり、他の研究グループによる実験に比べても投与量を5分の1まで減らすことができたという。
山田教授は「今後は、ミトコンドリアに直接薬剤を届けないといけない神経疾患や、ミトコンドリア病といった難病に対して有効な成分のカプセルを作りたい。ミトコンドリアに効くということは、裏を返せばわざと活性酸素を放出して細胞死を促し、がんを治癒させるといった方法も考えられる」と話した。
研究は北海道大学機能強化促進事業、科学技術振興機構(JST)創発的研究支援事業、コーセーコスメトロジー研究助成、日本薬学会長井記念薬学研究奨励金の助成を受けて行われ、成果は英オンライン科学誌「サイエンティフィック・リポーツ」5月10日版に掲載された。
関連リンク




