睡眠や体温などを24時間周期で制御する体内時計の中枢は脳の視交叉上核にあり、1日の体や行動のリズムを決めている。その中のどの細胞が時計の本体かを示す重要な研究論文が日本から相次いで報告され、ともに3月4日付の米科学誌ニューロンのオンライン版に載った。まず、筑波大学国際統合睡眠医科学研究機構の柳沢正史(やなぎさわ まさし)機構長(教授)と米テキサス大学のジョセフ・タカハシ教授らは、マウス脳内の視交叉上核に体内時計を調節して統合するペースメーカー細胞が存在することを突き止めた。
一方、金沢大学医薬保健研究域医学系の三枝理博(みえだ みちひろ)准教授、櫻井武(さくらい たけし)教授、北海道大学、理化学研究所のグループは、視交叉上核の特定の神経細胞が概日リズム周期や活動時間の長さを決めることを見いだした。いずれもマウスの遺伝子操作実験などで発見した。両研究は補完しあって、ヒト体内時計の中枢の実体を絞り込み、その機能に迫り、睡眠障害などの新しい治療法に道を開く成果として注目される。
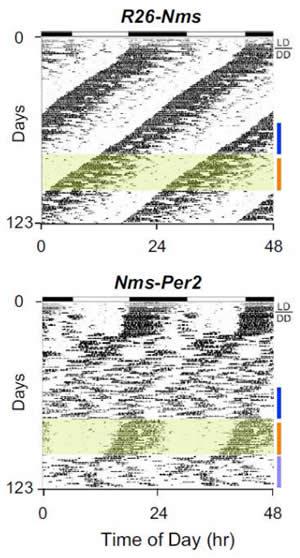
ヒトを含む哺乳類の行動やさまざまな身体機能は約24時間の周期を刻んでいる。こうした体内時計の中枢は脳の視床下部の視交叉上核という狭い領域にあることはわかっている。しかし、100種類以上の神経ペプチドや成長因子などを分泌する約2万個の不均一な神経細胞からなる視交叉上核の中で、どの神経細胞群が時を刻むのに中心的な役割を果たしているかは謎だった。筑波大学の柳沢正史教授らは、視交叉上核の約40%を占めるニューロメジンS(NMS)産生神経細胞群がペースメーカーのように働いていることを実証した。
柳沢正史教授らはマウスの最新の分子遺伝学的手法を駆使して、NMS産生神経細胞群の時計を任意のタイミングで操作し、止めたり動かしたりできるシステムを構築して実験した。この細胞群の時計分子の振動を止めると、視交叉上核全体と行動のリズムがなくなった。また、細胞群の変異でリズム周期を遅くすると、行動のリズムも遅くなる。さらに、NMS産生神経細胞群からの神経伝達を阻害すると、行動のリズムが消えた。
一連の実験から、柳沢正史教授らは「NMS産生神経細胞群が生物時計のマスタークロック」と結論づけた。ただ、遺伝子操作でNMSそのものを作れなくしても、行動のリズムは起きたため、このプロセスで重要な役割を果たしている神経伝達物質はわかっていない。柳沢教授は「NMS産生神経細胞群が使っている神経伝達物質がまったく未知か、既知の物質の組み合わせか、などをさらに追求していきたい。この神経細胞群を標的にして、概日リズム障害に関連した病気の診断や治療が可能になるだろう」としている。
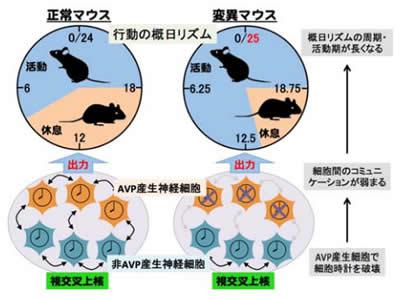
金沢大学の三枝理博准教授らは、視交叉上核で神経ペプチドのアルギニンバソプレシン(AVP)を産生する神経細胞に着目し、このタイプの細胞だけで時計を壊した変異マウスを作製した。真っ暗にして飼育すると、正常マウスは24時間より少し短い概日リズムを示すのに対して、この変異マウスは周期が1時間ほど長くなった。1日の活動期も5時間長くなって19時間に達し、休息期が短くなった。ヒトに例えると、活発になり、就寝時刻が毎日遅れていく実際の症状に相当した。全般に変異マウスは体内時計の働きが弱まっていた。
さらに、変異マウスの視交叉上核を切片の分析で詳しく調べたところ、AVP産生細胞で、神経細胞間の情報伝達に重要な複数の遺伝子の発現量が激減していた。各AVP産生細胞が刻む概日リズムが弱く不安定で、周期は長くなっていた。三枝理博准教授は「AVP産生細胞が概日リズム周期を安定させるネットワークに重要だ」と指摘している。
同じような手法で、結果もやや似ているが、どう絡むのか。三枝理博准教授は「2つの研究結果は矛盾しない。柳沢正史教授らの実験は重要で、NMS産生神経細胞群の中心的役割を明確に示した。ただ、そのNMS産生神経細胞群も均一ではなく、多様な神経ペプチドを分泌する細胞群が混ざって、ネットワークを形成している。われわれが研究したAVP産生神経細胞も、その一部を構成している。NMS産生神経細胞群の複数のサブグループの間でどのような役割分担があるのかを理解する、手かがりになるだろう」と話している。体内時計の元締め、視交叉上核の謎はなお残り、追試も含めて、時計本体の追求はまだ続きそうだ。
関連リンク
- 筑波大学 プレスリリース
- 金沢大学 プレスリリース




