腸管の免疫細胞が腸内細菌に対する炎症応答を抑制するために必須の遺伝子を、慶應義塾大学薬学部の長谷耕二(はせ こうじ)教授らがマウスの実験で見つけた。腸内細菌と宿主免疫系との共生の仕組みを解明する手がかりとして注目される。炎症性腸疾患の新しい治療法開発などのヒントにもなる。東京大学医科学研究所や理化学研究所、かずさDNA研究所、国立国際医療センターとの共同研究で、4月28日付の英科学誌ネイチャーイムノロジーのオンライン速報版で論文を発表した。
ほ乳類の胎児は、生まれる前の母体内で無菌状態だが、生後に膨大な数の細菌にさらされる。その激変に伴う過剰な免疫反応による炎症を抑えるために、制御性T細胞が働くとみられている。しかし、出生直後の無菌環境から腸内細菌が定着する際に、制御性T細胞がどのような仕組みで活性化し、腸内細菌と宿主の免疫系の間に共生関係がどのように構築されていくかについては、よくわかっていなかった。腸管免疫系の制御異常は、食物アレルギーや炎症性腸疾患の主因と考えられているだけに、重要な研究テーマになっている。
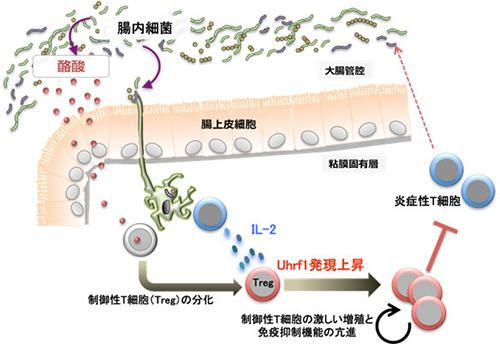
研究グループはまず、無菌マウスに腸内細菌を投与して、投与されたマウスの大腸機能を調べた。腸内細菌の定着によって、制御性T細胞が大腸で増殖することを確かめた。さらに、腸内細菌が定着すると、制御性T細胞でUhrf1という遺伝子の発現量が上昇していることを見つけた。T細胞だけでこの遺伝子が欠損したマウスを作って、正常マウスと比べたところ、欠損マウスは制御性T細胞が増えなくなり、免疫を抑える機能が低下していた。
Uhrf1の機能を解析し、DNAメチル化を通じて制御性T細胞の増殖や生体の恒常性維持に関わっていることも突き止めた。一連の実験から研究グループは「Uhrf1の遺伝子が作る分子は腸内細菌と宿主免疫系の共生関係を構築するのに重要な役割を果たしている」と結論づけた。
長谷耕二教授は「腸内細菌の異常がさまざまな病気に関連していることが最近わかってきた。腸内細菌と大腸の免疫系との共生は重要な意味を持つ。今回の発見は、治療が難しい炎症性腸疾患の発症の仕組み解明や、新しい治療法の開発にも役立つだろう」と研究の発展を展望している。
関連リンク




