体内の病巣にたどり着いて的確に治療するナノマシンへの期待が高まっている。全身投与が可能で、光が照射された標的の細胞に選択的に遺伝子や薬物を導入できる新世代のナノマシンの開発に、東京大学大学院工学系研究科の片岡一則教授と東京工業大学資源化学研究所の西山伸宏教授らが成功した。将来の体内病院を実現する新技術として注目されている。4月2日付の英オンライン科学誌ネイチャーコミュニケーションズに発表した。
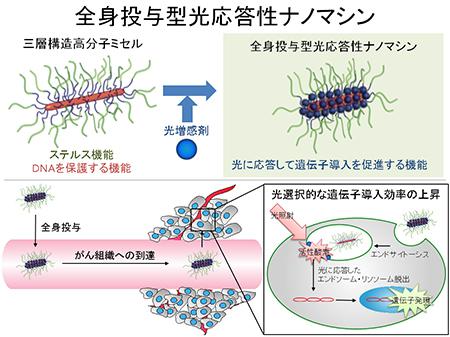
がん治療や再生医療などでは、体内の狙った部位に遺伝子や薬物を導入する安全な技術が不可欠となっている。片岡教授らは、遺伝子導入の効率と選択性に優れた新システムとして、3層構造の高分子ミセルで光に応答するナノマシンを設計して構築した。皮下にがんがあるマウスにこのナノマシンを投与し、がん病巣に光を照射して、光選択的に遺伝子を導入することに世界で初めて成功した。
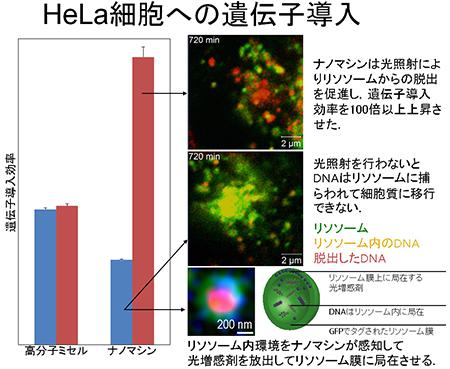
高分子からなるこのナノマシンは、長さ90ナノメートル、直径10ナノメートルの棒状で、長さ17ナノメートルのひげをたくさんくっつけている。親水性の外殻膜、光増感剤を含む中間層、DNAを内包した内核層の3層から構成される。がん組織に集まって、がん細胞に入り込む。がん組織に光を照射すると、ミセル内の光増感剤が働いて活性酸素を発生し、細胞内のリソソーム膜を溶かして、核にDNAを運び込む。光の照射で遺伝子導入効率が100倍に上がることを確かめた。
このナノマシンは、ウイルスベクターなどの既存の遺伝子導入技術に比べて、安全性と選択性に優れている。静脈注射によって全身投与も可能で、がんや動脈硬化などさまざまな病気の遺伝子治療への応用が期待される。病気を細胞レベルで治療することを可能にする技術で、1966年の米SF映画「ミクロの決死圏」の世界を実現した。抗がん剤を含む第1世代のナノミセルは先行して、臨床試験の最終段階に入っており、数年後には新薬として使われる可能性がある。
片岡教授は「われわれが取り組んだ内閣府の最先端研究開発支援プログラム(FIRST)で新しい芽が出てきた。それがこの光応答性ナノマシンだ。単なる新薬という枠を超えて、誰でもどこでも使える医療機器の『体内病院』になるだろう。10年後には、臨床応用まで持っていきたい」と意欲を見せている。
関連リンク




