日本では今、夫婦の5.5組に1組が、不妊の検査や治療を受けているか、または過去に受けたことがあるそうだ。不妊の原因は多岐にわたり、晩婚化などの社会の変化も遠因となって、不妊に悩む人は増える傾向にある。生殖補助医療、いわゆる「不妊治療」は、このような時代の流れを受けて発展してきたともいえる。2015年の統計では5万1001人が体外受精などの不妊治療により誕生しており、これは全出生児の約20人に1人にあたる。
不妊治療の最大の目的は子どもを授かることであり、不妊の原因そのものを突き止めて治すことではない。そもそもヒトの生殖研究は、技術面だけでなく倫理的な側面からもできることが限られ、この科学全盛の時代にあってもわからないことがたくさんある。しかし、不妊治療も他の医療と同様に、明確な生殖メカニズムの理解と、それに基づく根本的な治療を行えるようになることが理想だ。
困難な、そして人類の存続にさえかかわるこのテーマに取り組んでいるのが、京都大学大学院医学研究科の斎藤通紀教授である。斎藤さんは京都大学iPS細胞研究所の主任研究者も務めている。斎藤さんの研究のユニークさは、ヒトの生殖メカニズムを直接見ることができないならば、試験管の中で再現してみようという視点にある。斎藤さんらの研究グループはこのほど、ヒトのiPS細胞から卵子の元となる「卵原細胞」を作り出すことに成功したことを、米国の科学論文誌『サイエンス』で発表した。
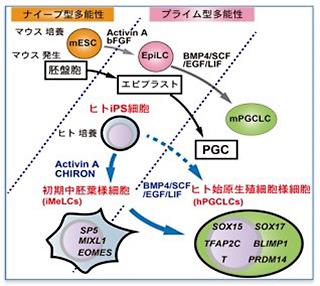
ヒトのiPS細胞は生殖細胞に変えることが難しい「プライム型」
今や基礎研究だけでなく、医療分野でもその地位を確立しつつあるiPS細胞だが、ほんの十数年前にはSF小説の中の話でしかなかった。37兆個もあるといわれるヒトの細胞は、もとをただせば受精卵というたった一つの細胞に由来する。細胞は分裂によって数を増やしながら、特定の組織や臓器にふさわしい形や性質に成長する。これを細胞の「分化」と呼ぶ。細胞はいったん分化すると、いろいろな細胞になる能力を失う。この自然界の常識を覆したのが人工多能性幹細胞、すなわちiPS細胞である。斎藤さんらのグループはiPS細胞やES細胞などの多能性幹細胞、つまり「さまざまな種類の細胞になる能力を持つ細胞」を使って、生殖メカニズムの解明に取り組んでいる。
細胞は骨や筋肉、神経細胞など、体のほとんどを占める「体細胞」と、精子や卵子を指す「生殖細胞」に大別できる。生殖細胞のもととなる「始原生殖細胞」ができるのは、ヒトが母親の胎内に宿って4週目ぐらいのことであり、実際に観察するのは極めて困難だ。この細胞は精巣、または卵巣に移動して、それぞれ精原細胞、卵原細胞となり、分裂を繰り返してやがて精子、卵子になる。
斎藤さんらはまず、ヒトのiPS細胞から始原生殖細胞を作り出した。斎藤さんによれば、iPS細胞は生物種によってその性質が異なるそうだ。たとえばマウスのiPS細胞は、体の中のすべての種類の細胞に変わる能力を持つ「ナイーブ型」であるのに対し、ヒトのiPS細胞は、体細胞にはなるが生殖細胞に変えることは難しい「プライム型」だという。そこで斎藤さんらは、ヒトのiPS細胞をいったん「中胚葉」と呼ばれる細胞の系列に変化させることで、効率よく始原生殖細胞を作りだす方法を開発した。
ヒトのiPS細胞とマウスの細胞を合わせた「異種間卵巣」
斎藤さんらは以前、マウスのiPS細胞から卵原細胞を作成している。今回はその経験を生かし、同様の方法で実験を行った。ヒトiPS細胞から誘導した始原生殖細胞を、マウスの卵巣から取り出した細胞と一緒に試験管内で凝集させ、卵巣に似た構造を再構成したのだ。この「ヒトとマウスの異種間再構成卵巣」を約3カ月にわたって培養したところ、ヒトiPS細胞由来の始原生殖細胞は卵原細胞に分化した。
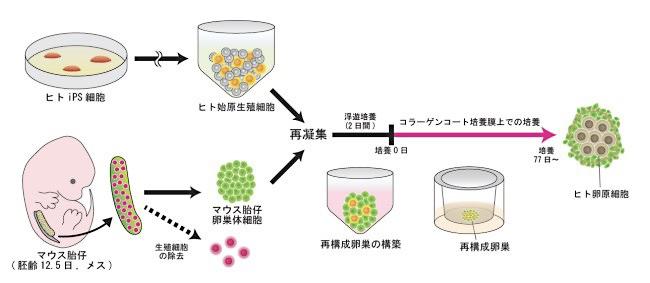
卵原細胞に分化したことは、細胞の形や、そこでだけ働く遺伝子を調べることで確かめられるそうだ。さらに、生殖細胞に特有の「エピゲノムリプログラミング」という現象も確認できた。エピゲノムとは、遺伝子(ゲノム)の本体であるDNAに、生まれた後で加わった化学変化のことだ。同じ遺伝子を持つ双子でも、エピゲノムの状態が異なることで、外見や病気のなりやすさなどが違ってくることがある。このようなエピゲノムの化学変化は、生殖細胞がつくられる過程で取り外されることがわかっている。それが「エピゲノムリプログラミング」で、今回の実験では、卵原細胞ができる過程でこの現象の最初のステップが確認できた。
ただし、今回の実験で、ヒトiPS細胞由来の始原生殖細胞から卵原細胞が分化するのにかかった時間は、ヒトの体内で実際に卵原細胞ができる時間の約2倍だったそうだ。斎藤さんによれば、マウスのiPS細胞を使った場合には、体内と時間は変わらないそうだ。ヒトとマウスの細胞を合わせた異種間再構成卵巣という環境が、ヒトiPS細胞の分化には「ベストではない」ことの表れだと斎藤さんは考えている。
ヒトの始原生殖細胞が精子や卵子に至る過程については不明な点が多い。生殖の研究ではマウスなど他の動物を使った実験や観察に頼らざるをえないが、同じ哺乳類であっても、マウスとヒトの生殖のしくみはかなり異なっている。iPS細胞の技術は、ヒトの生殖メカニズムを、ヒトの細胞を使って研究することを可能にしようとするものだ。
iPS細胞を使った生殖研究は不妊治療の効率を上げる
今後、斎藤さんらはヒトのiPS細胞から卵子を作ることに挑戦するそうだ。ヒトの体内ではすべての卵原細胞が、胎児の間に「卵母細胞」という次の形態に姿を変える。思春期になると、ひと月に1個の割合で卵母細胞から卵子が作られる。卵母細胞の数は年齢とともに減り、ひとりの女性が一生の間に作る卵子は400個程度だという。こうしたヒトの自然な営みをiPS細胞で人工的に再現する日は、すでにマウスでは実現していることを考えれば、そう遠くはないだろう。現在の日本の指針では、ヒトのiPS細胞やES細胞から卵子や精子を作ることは認められているが、受精、および受精卵を体内に戻すことは禁止されている。この先も倫理的側面から、「人工卵子」が生殖そのものに使われる可能性は極めて低いだろう。
しかし、もしヒトのiPS細胞から卵子を作り出すことができれば、「生殖補助医療の研究を進めるための強力なツールになるだろう」と斎藤さんは言う。体外受精などでは、体内から取り出した未熟な卵子を試験管内で培養する必要がある。治療の効率を上げるには培養条件なども繰り返し検討する必要があるが、その機会は限られている。もしiPS細胞からたくさんの卵子を得られるようになれば、さまざまな条件を試すことができ、その知見を生かして不妊治療の効率を上げることができるだろう。ヒトiPS細胞から作られた卵子が不妊治療に貢献するようになることを期待したい。
※ 図はいずれも京都大学のプレスリリースより。
(サイエンスライター 工樂真澄)
関連リンク





