
抗体医薬の現状と課題
今後の創薬において、「バイオ医薬」(タンパク質、核酸など)への期待は極めて大きい。医薬全体では、従来からの“低分子化合物”の割合は依然として高いが、将来はバイオ医薬がそれと肩を並べるという予想もある。バイオ医薬のうち、“タンパク質医薬”としてはワクチンや抗体医薬があり、国際的に激しい競争の下で急速に成長している。とくに期待の大きい抗体医薬の開発では、標的となる血液・体液中のタンパク質や細胞膜表面にある膜タンパク質を選択的に認識・結合する「モノクローン抗体」が用いられ、それらのタンパク質の働きを抑える抗体(中和抗体)、抗体の本業である免疫の仕組みを使って標的細胞を死滅させる抗体(ADCC抗体)が開発された。他方、マウスなどの抗体をヒト化する技術、完全なヒト型抗体を得る技術へと進み、今は、抗体を改良して、バイスペシフィック抗体技術をはじめとする、機能を高度化する技術が焦点となっている。
さらに今後の発展が予想され、大きな注目を集めているものが「抗体薬物複合体」(ADC)である。これは、標的とする細胞表面の抗原タンパク質を認識する抗体を用いて、薬剤を送り込む。この考え方は古くからあり、「ミサイル療法」とも呼ばれるが、最先端の技術の登場によって新たな段階に入り、これまでの抗体医薬の限界を打破するものとして期待されるようになった。多くのADCが開発の最終段階に入っているとみられ、既に2種のADCが上市された。抗体医薬の開発は、欧米ではベンチャー企業が担っている場合が多く、昨年から今年にかけて、大手製薬企業との大型契約が次々と発表され、熱い視線を浴びているのである。(図1)
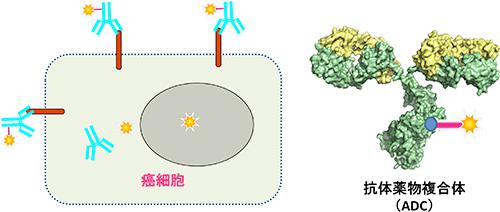
ヒトゲノムには2万を超えるタンパク質がコードされ、低分子医薬に限らず、抗体医薬の観点からも、次々と創薬標的が見いだされている。そのようなタンパク質を標的とする抗体医薬開発で鍵を握るのが、タンパク質を取り扱う技術である。モノクローン抗体を開発するためには、免疫原(抗原)となる標的タンパク質を調製する必要があるが、それらは性質がさまざまであり、発現が困難であったり、不安定であったりする。特に標的として重要な膜タンパク質については、純化した試料を十分量調製することが容易ではない。このタンパク質調製技術の点で、我が国には国際的にもトップを競う強さがある。それは、2002年から行われた「タンパク3000プロジェクト」により、多種類のタンパク質を大量に調製する技術基盤が作られ、07年から行われた「ターゲットタンパク研究プログラム」の成果として、膜タンパク質などの創薬標的を調製するための技術高度化を達成しているのである。
タンパク質合成技術における我が国の“強み”
そこで開発された我が国の技術の大きな特徴は、「無細胞タンパク質合成技術」である。複数の研究グループが世界を牽引しており、国際的にも類をみない“お家芸”ともいえる。この技術では、通常の遺伝子組み換えによるタンパク質発現技術(大腸菌などの宿主細胞に目的タンパク質を作らせる)とは異なり、細胞を破砕した抽出液などにさまざまな工夫を加え、試験管の中で転写から翻訳の過程を経て正しく機能するタンパク質を完成させる技術である。この技術を用いると、生きた宿主細胞に対しては適用できないコントロールが可能になり、自然の枠組みの制約の下では容易には作り得ないタンパク質(ヒト由来の膜タンパク質や巨大なタンパク質複合体など)をも作製できる。
さらに、このような無細胞タンパク質合成技術や、動物培養細胞を用いる合成技術を駆使することにより、「Gタンパク質共役受容体」(GPCR)などの膜タンパク質を含めて、抗体医薬の開発に必要な抗原タンパク質を調製することができる。無細胞合成技術によって抗体を調製して、抗体の高度化に利用することも可能になってきている。このような我が国の“強み”は、今後の抗体医薬開発において、大いに生かされていくと考えられる。
「タンパク3000プロジェクト」は、ヒトゲノム解読の完了を待たずに開始され、遺伝子の機能を解明する際に大きな手がかりを与える立体構造(3次元構造)の情報基盤を確立することを目指すとともに、ゲノム規模の構造解析を可能にする試料調製と構造決定の技術基盤を確立するものであった。国際的には「構造ゲノミクス」と呼ばれ、米国をはじめとする各国の協調によって進められた。中でも我が国の貢献度は非常に大きく、それのみでなく、現在のバイオ医薬開発にも大きく寄与する基盤につながったのである。
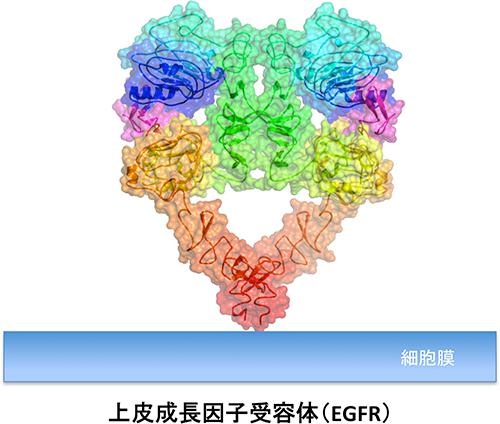
さらに、プロジェクト開始時(02年)には、微生物タンパク質の1つの立体構造を決定するのに数年を費やすのは普通であったが、プロジェクト終了時(07年)には状況が一変し、4000を超えるタンパク質構造の決定がなされた。現在、抗体医薬さらに低分子医薬においても、最も顕著な標的の1つといえる「上皮成長因子受容体」の複合体構造も02年に決定された(図2)。それらの成果は、タンパク質立体構造の体系的な理解に大きく役立ったことも、その後の研究により確認された。このような試料調製から立体構造決定に至る解析の技術基盤(図3)は、抗体の高度化にも生かされると期待される一方、低分子医薬の探索、最適化に今や必須となった立体構造情報の取得においても、極めて重要な役割を果たしている。

なお、タンパク質の立体構造情報を手がかりとした創薬(SBDD〈Structure-based drug design〉やFBDD〈Fragment-based drug design〉)については、テクノフロント2012年12月7日第12回の本間光貴氏の稿「インシリコ創薬による難病克服への挑戦」を参照されたい。
タンパク質の立体構造は、タンパク質機能を改変し、高度化する際にも必須の役割を果たす。上に述べたような高度化された立体構造解析技術基盤は、タンパク質を作る技術の高度化にも生かされた。細胞におけるタンパク質生合成(遺伝情報の翻訳)の過程では、遺伝暗号表に載っている20種類の天然型アミノ酸を用いてタンパク質が合成される。その過程でアミノ酸を利用する(トランスファーRNAに結合させる)特異性を担っている酵素も20種類存在する。それらの立体構造が次々と解明されたことに伴い、そのアミノ酸特異性を変えるエンジニアリングも大きく進展し、多くの種類の非天然型アミノ酸を、翻訳過程で、タンパク質の特定の部位に導入する技術が開発されていった。この新規技術の開発においても、我が国は世界を牽引する役割を果たしている。
実際、ヒトなどの生物は、20種類のいわゆる「天然型」のアミノ酸では満足しておらず、タンパク質を合成したのち、さまざまな酵素を駆使して「翻訳後修飾」を施す。代表的なリン酸化、糖鎖修飾などに加えて、「リシン」(20種類の1つ)のアセチル化、メチル化などが近年、特に注目されている。真核生物のDNAは、ヒストンタンパク質の複合体に巻き付けられたヌクレオソームとして存在し、その制御は、遺伝子発現に極めて重要である。そのヒストンタンパク質には、リシンのアセチル化とメチル化が施され、中心的な役割を担っている。これは、「エピジェネティクス」というタイプの遺伝子発現などの制御の中核となるもので、エピジェネティクス関連酵素は、極めて重要な創薬標的と考えられ、激しい競争の下、開発が進められている。ところが、エピジェネティクスの修飾をもつタンパク質試料の調製は容易ではなかった。ここで、上に述べた「非天然型アミノ酸導入技術」が応用され、エピジェネティクス修飾をもつヌクレオソームの大量調製が世界で初めて可能になり、構造と機能の基礎研究から新規の創薬開発にまで、大きく貢献することが期待されている。
“強み”を生かした抗体医薬開発への期待と課題
ここで、はじめに述べた抗体医薬の開発に話を戻そう。
ADC(抗体薬物複合体)の開発においては、抗がん剤などの薬剤を抗体に結合させる必要があるが、従来は、結合の効率が高くなかったり、薬剤の結合によって抗体の機能が低下してしまったりという、さまざまな問題があった。技術の改良が進められ、現在の活発な開発に至ったが、さらに大きな飛躍をもたらすと期待されるのが「非天然型アミノ酸導入技術」である。これにより、抗体の構造・機能を乱すことなく、最適の部位にほぼ100%の効率で薬剤を結合させることができる。既に、国際的な開発競争が激化しているが、我が国の技術は、大きなアドバンテージを有している。その応用範囲は極めて広く、上述した抗原タンパク質試料調製の高度技術と合わせて、今後のバイオ医薬開発の中で、大きな役割を果たすことになることが期待される。
そのためには、米国のベンチャー企業が果たしている役割を我が国で担うための研究開発体制を、産官学が協力して推し進めることに大きな意義があると私は考えている。我が国の医学研究からは、今後も、抗体医薬の重要な標的が次々と見いだされるであろう。そのような研究を競争力のある抗体医薬の開発へと結びつけていくには、そのような開発体制の充実が必須の課題となるであろう。

(よこやま しげゆき)
横山 茂之(よこやま しげゆき) 氏 プロフィール
1953年東京都生まれ。75年3月東京大学理学部生物化学科卒業、81年3月同大学院理学系研究科博士課程修了。82年1月東京大学理学部助手、86年7月助教授、91年8月教授。93年4月東京大学大学院理学系研究科教授、同10月理化学研究所主任研究員。96年10月科学技術振興機構(JST)・ERATO(戦略的創造研究推進事業)「横山情報分子プロジェクト」総括責任者。98年10月理化学研究所ゲノム科学総合研究センタープロジェクトディレクター。2008年4月理化学研究所横浜研究所生命分子システム基盤研究領域(SSBC)領域長。13年4月から現職。東京大学名誉教授。




