
インシリコ創薬の最近の進歩
1970年代まで、創薬(医薬品候補の探索)は、努力と勘と運に頼った方法で行われていた。すなわち、「社内化合物」あるいは野外で採集した天然化合物からなるライブラリーを端から薬理評価(スクリーニング)し、ヒットした化合物の構造を合成しやすい部分から順に変換し、見つかった薬効の高い化合物を医薬品に導いていた。その後、論理的な創薬を目指して、コンピュータによる予測を利用した創薬「インシリコ創薬」が始まったのは、1980年代半ばごろからである。しかし黎明期は、コンピュータの性能も低く、予測方法も未成熟で、いくつかの比較的単純な例で役に立つことを示す段階に留まり、創薬の現場で多くの創薬プロジェクトに貢献することはできていなかった。
ようやく2000年代から、低分子化合物の薬理活性データベース、タンパク質の立体構造データベースなどの情報が充実してきたこと、予測方法のアルゴリズムの高度化が進んだこと、およびコンピュータの性能が向上したことから、創薬の現場でコンピュータ予測が実用的な段階に入ってきた。「インシリコスクリーニング」※1と呼ばれる手法では、数十万から数千万個の化合物データベースの中から、疾患ターゲットへの結合親和性の高い化合物を、非常に高速なタンパク質−低分子リガンド(医薬品程度のサイズの化合物)間のドッキングによって評価し、選択することが可能となっている。(図1)
※1. インシリコスクリーニング:インシリコ(in silico)とは「コンピュータ(シリコンチップ)の中で」の意味で、「in vivo」(生体内で)や「in vitro」(試験管内で)に対応して作られた。コンピュータを使ったスクリーニング法のこと。
最近の予測方法の一例として、従来は、タンパク質構造の自由度(動き)の考慮が不十分であったが、図1の「PALLASシステム」では、さまざまな状態のX線構造に加え、分子動力学(MD)シミュレーションによってタンパク質の振る舞いを予測し、既知化合物の薬理活性データベースを用いて検証することによって、成功率の高い予測方法を選ぶことができるようになっている。また、妥当なドッキングを行った後には、得られた複合体構造モデルから結合親和性を予測することが必要になるが、この目的にも、タンパク質−低分子リガンド間の相互作用をパラメータ化し、統計理論に基づいた機械学習によって予測する手法「MUSES」が開発されている。
これらは、分子をコンピュータで扱うさまざまな理論的方法と統計的な予測方法を組み合わせており、理論での予測を実測値で補正するシステムとなっている。そのため、最近の高速なウェットのスクリーニング技術(HTS:ハイスループットスクリーニング)やX線などによる構造解析技術と大変相性が良く、新しく得られたデータを最大限活用できる。情報量にもよるが、従来の方法の2倍から4倍以上も効率的なインシリコスクリーニングが実施可能となった。
これらのシステムによって、20個以上の疾患関連ターゲットに対してインシリコスクリーニングが実際に行われ、そのほとんどにおいて医薬品の種となる化合物(創薬シード)を発見することに成功している。
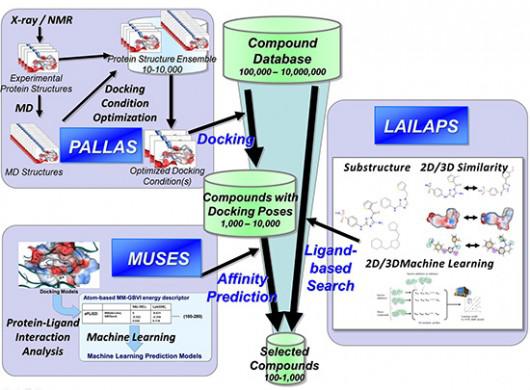 |
| 図1.膨大な化合物から医薬品候補化合物を絞り込むインシリコスクリーニングの最近の方法 |
難病克服に対する挑戦
ヒトゲノムの解析によって、約2万5000個の遺伝子が同定された。それらの遺伝子によってコードされるタンパク質は、ヒトの体内でさまざまな役割を果たしており、その一割にあたる3000個程度の遺伝子が何らかの形で疾患に関与しているといわれている(図2)。疾患に関与する遺伝子の研究は近年急速に進んでおり、読者の皆さんも「○○病の治療薬に繋がる遺伝子を発見!」というニュースを日常的に目にする機会が多いのではないかと思う。しかし、これらの疾患遺伝子(Disease genes)のうち、現在、上市されている医薬品のターゲットとなっているのは、わずか215個にすぎない。
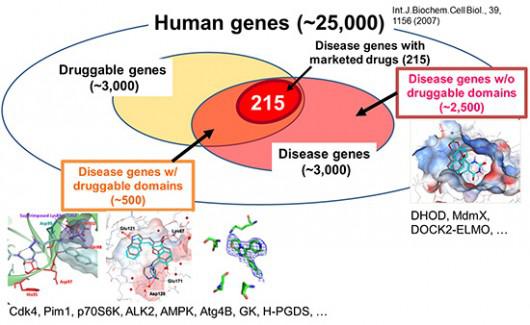 |
| 図2.疾患関連遺伝子(Disease genes)と創薬の難易度(Druggability) |
残りのターゲットは、さまざまな理由から創薬が進んでいない。理由の一つは、それらの遺伝子でコードされるタンパク質の形状が、低分子医薬品が作用(結合)しにくい平坦な形となっているからである。深いポケット状の部分が無いと、物理的に低分子医薬品が結合しにくくなるためで、これらは「Undruggable gene」(創薬が困難な遺伝子)と呼ばれる。また、疾患の患者数が先進国では少ないなど、経済的な理由で放置される場合も少なくない。これらの疾患は「Orphan disease」(希少疾患)や「Neglected disease」(顧みられない疾患)と呼ばれる。
図2において“Disease genes”と“Druggable genes”の重なる部分が、まだ医薬品が開発されていない部分の一部に該当する。それらのターゲットに挑戦するためには、従来よりも効率的で成功率の高い創薬が求められており、前述のインシリコ創薬を利用することが重要である。
理化学研究所では、さまざまな大学・研究機関・企業と連携し、これらのまだ医薬品開発に至っていないターゲットに対する創薬に取り組んでいる。“Druggable”ではあるが、医薬品に至っていないターゲットについては、すでに述べたように20種類以上のターゲットに対してインシリコスクリーニングを実施し、シード化合物の発見に成功している(図2の左下部分)。また、疾患関連ターゲットで“Undruggable”であるもの(図2の右下部分)についても取り組んでおり、いくつかのターゲットでは、「IC50」(50%阻害濃度)が2μM(マイクロモーラー)を切る高い活性をもつ化合物を発見することに成功している。
それらのターゲットに対しては、いきなり医薬品サイズの化合物のインシリコスクリーニングを実施しても、市販の化合物からはなかなか良い化合物が見つからないので、最初は「フラグメント」(医薬品の20-30%程度の大きさ)や「スキャフォールド」(医薬品の30-50%程度の大きさ)といった小さな化合物をスクリーニングし、発見したフラグメントを組み合わせて高活性化合物を設計する「FBDD(Fragment-Based Drug Discovery)」の手法が重要である。これは、結合サイトの重要な部分に結合するフラグメントを最初に探索し、それらのフラグメントを組み合わせたり、構造最適化することによって、新規で活性の高い化合物に導く方法であり、フラグメント組み合わせの過程で、ターゲットへの特異性(特異性が悪いと副作用が出る場合がある)や体内動態を考慮して設計することも可能である。図3にFBDD的アプローチの例を示す。
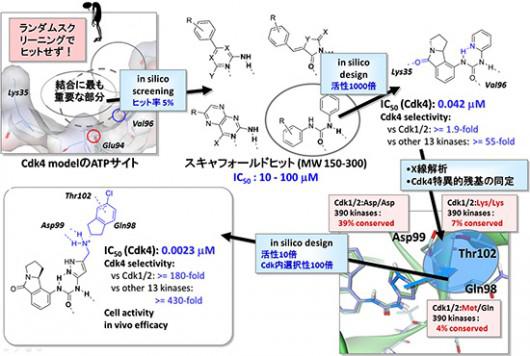 |
| 図3.小さな化合物を組み合わせて新しい医薬品を産み出すFBDD的手法の例 |
また、東大医学部の北潔教授と共同研究を行っているトリパノソーマ治療薬のターゲット「DHOD(ジヒドロオロテートデヒドロゲナーゼ)」に対しても、非常に活性の弱い化合物しか知られておらず創薬が困難(Undruggable)であったが、タンパク質の構造を意図的に変えることによって、低分子との結合能力を増強し、「IC50: 0.15μM」を示す活性の高い化合物の発見に成功している。
最後に -京コンピュータに対する期待-
今回紹介したインシリコ創薬は、神戸にある世界最速クラスのスーパーコンピュータ「京」と連携することによって高効率化するとともに、さらに難易度の高い創薬ターゲットに対する創薬も可能となる。計算スピードが速いので、インシリコスクリーニングの際に予測性能の高い方法を多くの化合物に適用できる。また、単に従来と同じ手法の計算の数を増やすだけではなく、これまでにない方法も可能となる。例えば、ある種のタンパク質は、何段階かの形状の変化を起こして機能を発揮している場合があるが、それらの形状のすべてをX線解析などで実験的に決定することは非常に難しい。「京」による、これまでとは桁違いの長時間のシミュレーションによって、これらの形状を明らかにできれば、従来利用できなかった形状の医薬品結合サイトを利用できるようになり、難易度の高いターゲットに対しても創薬を展開できる可能性が広がる。
日本では、「京」コンピュータに加えて、量子化学的計算を効率化する「フラグメント分子軌道法(FMO法)」や大規模シミュレーションによる活性予測など、世界的にも優秀な要素技術を持っており、予測方法として成熟させ、用途・目的に応じてシームレスに使い分けるシステムを構築できれば、マーケットの大きな医薬品(ブロックバスター)はもちろん、希少疾患や顧みられない疾患の治療薬を輸出する国となるのも夢ではない。

(ほんま てるき)
本間 光貴(ほんま てるき) 氏 プロフィール
1969年、北海道小樽市生まれ。1987年、小樽潮陵高校卒業。1993年、北海道大学理学研究科修士課程修了。(2001年博士〈理学〉取得)1993年から万有製薬つくば研究所で、タンパク質の構造に基づいた医薬品設計を研究。その後、ファイザー株式会社(主任研究員‐主幹研究員)にて一貫してインシリコ創薬に取り組み、2007年からアカデミア発の難病治療薬の発見を目指し、理化学研究所(上級研究員)に移る。08年から現職。10年からは創薬事業の立ち上げとともに、創薬・医療技術基盤プログラムのマネージャーを兼任する。




