京都大学医学部附属病院が今年4月、同大iPS細胞研究所(CiRA)と連携して実施したパーキンソン病治療の医師主導治験の結果を発表した。iPS細胞から作った細胞の移植による症状改善が認められたことは、画期的な事例として受け止められた。同時に、iPS細胞治療の普及への期待がますます高まりつつある。
研究チームを率いるのは、CiRA所長・教授を務める髙橋淳さんだ。もともと脳外科の医師でありながら「異常な部位を取るのではなく、正常なものを作ることをやりたかった」と語る髙橋さんに、今回のパーキンソン病治療の治験にかかわるエピソードと、今後のiPS細胞治療の未来を伺った。

前例のない取り組み、動物が死ぬまで観察
―今回の医師主導治験の開始に至る過程で経験された課題、ハードルを教えてください。
なにしろ前例のない取り組みだったこともあり、基礎研究から臨床研究、治験という流れのそれぞれで課題がありました。安全性の証明にしても、例えば造腫瘍性試験(筆者注:細胞から作られる再生医療など製品の開発の際に、原材料や製品のがん化リスクを測るために実施する試験)をどう行うのか? ということすらわかっていなかったわけです。
結局、実験動物の移植部位に最大投与量のiPS細胞由来ドーパミン神経前駆細胞を入れて、その動物が死ぬまで観察を続けました。50週近く経過したところで動物が死んだので、その時点で観察期間を決めたわけです。現在の観察期間のスタンダードは39週となっていますが、振り返ってみると過剰なほどに確認を行ったんですね。全ゲノム解析やエクソソーム解析、エピジェネティクスについても検討しましたから。
ただ、当時それをやったからこそ、ある種のコンセンサスができているのだとも思います。後に続く研究者が、そこまでやらなくてよくなったという側面があるのではないでしょうか。

既存の薬物が効きやすくなると想定
―パーキンソン病について、iPS細胞由来の細胞の治療法が特に有効な患者さんの属性などについて、なにか知見は得られていますでしょうか。
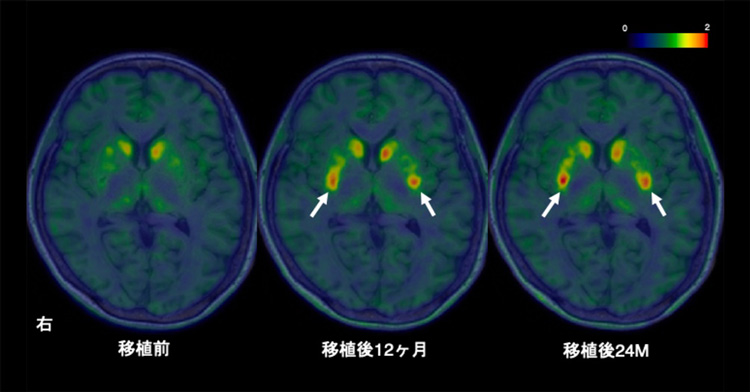
4月17日に発表した論文では「症状がそれほど重くなく、より若年の患者が適している」と書きました。ただ、パーキンソン病の患者さんだと、発症時点でドーパミン産生量は正常な方の半分くらいに減っている。ですので、非常に病状が軽い時点で介入して、症状を重くならない方向にもっていくことを最終目標として考えています。これは神経内科の先生とも合意しているところで、リソースを有効活用するうえでも望ましいのではないでしょうか。
今回の治験で良かったのは、安全性に加えて、iPS細胞由来の神経細胞の生着とドーパミン産生が確認されたことです。ただ、ドーパミンの産生量に注目すると、まだ正常には程遠い。ですから、症状が重い患者さんを回復させるのは難しいのが現状です。今のところ移植した細胞の量は動物実験のときと同じですので、規制当局とも折衝したうえで、より多くの細胞を入れて検証することが次のステップと考えています。
―そうすると、実際の治療時には、薬物療法との組み合わせも想定されます。レボドパ製剤などの既存のパーキンソン病治療薬との相性や留意点について、現段階でわかっていることはあるのでしょうか。
レボドパ製剤に関しては、より効きやすくなると考えています。そもそもレボドパ製剤は、神経細胞に取り込まれて、ドーパミンを作る材料になるものです。パーキンソン病ではこの神経細胞が失われていくので、iPS細胞治療で神経細胞を回復させると、ドーパミンをまた作ることができるようになる。製剤の効き目もより良くなるわけです。
いずれにせよ、今後は症例を重ねながらデータをとる過程に入っていきます。つまり、患者さんなしでは進まないフェーズになってきているわけです。
「疾患群」としてまとめるとスケールメリットも
―医療技術全般に言えることですが、より多くの患者さんに届けるための低コスト化や産業としての収益化が今後期待されます。これらについて、どのような見通しを立てられているでしょうか。
やはり、ある程度患者さんの数がおられる疾患に絞って導入することが第1の方針になると思います。日本では薬価の問題もあるので、現状ではほとんど利益は出ないかもしれません。規模を確保するという意味では、海外に進出することも必要でしょう。
実際、米国では治験がすでに始まっているので、海外に出て行く準備段階にあるといえます。それ自体は日本の技術で外貨を稼ぐことにもなるので、国益にもかなうものだと思っています。ただ問題は、患者さんがあまりおられない希少疾患をどうするかということです。
1つの戦略は、同じ方法で治せる病気を「疾患群」としてまとめることです。仮に、遺伝子編集による治療薬が1個できたとしたら、遺伝子配列を少し変えるだけで他の疾患にも対応できる可能性がある。そうすると、iPS細胞治療の対象疾患が広がることが十分考えられますし、スケールメリットが生じる可能性もあると考えています。

ロボットやAIで量産体制が間に合うか
―海外の研究機関との関係では、どうしても「競争」の側面が出てくるように思います。国際開発競争が厳しいなかで、iPS細胞の量産体制の確立やコスト削減策などをどのように進めていく予定でしょうか。
少なくともパーキンソン病に関しては患者さんがたくさんおられるので、1つの機関や組織が利益を独占するようなことはないものと予想しています。むしろ問題は量産体制が間に合うかどうかでしょう。これについては、海外用も含めた生産拠点を早い段階で作り、稼働させている企業もあります。
―最近では、iPS細胞の培養用のロボットや、培養条件を最適化するためのAIも登場してきています。こうした自動化が、iPS細胞研究にもたらすインパクトについてお考えをお聞かせください。
自動化は積極的に利用していく必要があるでしょう。もちろん細胞は生き物ですが、製造工程の画一化は、恩恵が非常に大きいとみています。まず培養条件の最適化や、培養装置の開発によるコスト削減が考えられます。
それから、手作業でばらつく部分の規格統一もあり得る。例えば今、培養施設では手書きのSOP(標準作業手順書)を保管していますが、これをすべて機械化していけば、システムのDX(デジタルトランスフォーメーション)化ができると思う。おそらく、5年後とか10年後には驚くような進展があるのではないでしょうか。
iPS細胞、遺伝子編集、デリバリーの融合で新時代を
―CiRAの設立から15年が経過し、基礎と応用双方で非常に多くの研究成果が蓄積されてきている印象を受けます。今後の展望や、この分野のさらなる発展に必要なことについて、お考えをお聞かせください。
ここまで引っ張ってきた僕らはもう去っていくので、これからは若い人の時代でしょう(笑)。真面目にお話すると、まずは技術革新を続けないといけない。iPS細胞自体の改良もそうですし、いろんな知見を取り入れて、さらに技術を高めなければいけません。横展開としては、臨床試験まで進んだ技術をちゃんと標準治療にすることが必要です。要するに皆が受けられる治療にするということですが、CiRAはその先頭に立たないといけないと考えています。
少し古い話になりますが、iPhoneが初めて発売されたときに、スティーブ・ジョブズが『我々の新製品は3つある。1つ目はワイドスクリーンのiPod、2つ目は画期的な携帯電話、3つ目が革新的な通信機器だ』とプレゼンしていましたよね。そのうえで『これは実際のところ、1つのデバイス、iPhoneだ』と言ったんです。私は、今のiPS細胞研究も同じ状況にあると考えています。
つまりiPS細胞があって、遺伝子編集があって、遺伝子を目的の部位に運ぶデリバリー技術がある。いずれもノーベル賞の対象になった技術ですが、これからの時代は、この3つが合わさって新しいものが生み出されていくのではないでしょうか。
関連リンク
- CiRAプレスリリース 2025年4月17日「「iPS細胞由来ドパミン神経前駆細胞を⽤いたパーキンソン病治療に関する医師主導治験」において安全性と有効性が⽰唆」
- 京都大学iPS細胞研究所(CiRA)





