「アトピー性皮膚炎」の患者は、先進国を中心に世界中で増え続けており、日本も例外ではない。生活への支障は大きく、効果的な治療薬が求められる中、今世紀になって基礎研究は世界的に大きく進み、新たな痒(かゆ)みのメカニズムも分かってきた。九州大学生体防御医学研究所 福井 宣規(ふくい よしのり)教授らのグループが最近発表した最新の研究成果は、その一つとして注目される。新しい創薬ターゲットも見えてきたようだ。
アトピー性皮膚炎とは
アトピー性皮膚炎は、痒みを伴う湿疹が体のさまざまな場所にでき、良くなったり悪くなったりを繰り返す皮膚の病気だ。患者の多くは、アトピー素因※1を持っていて、皮膚を外敵から守る「皮膚バリア」の機能が弱く、アレルゲン(痒みなどアレルギー症状を引き起こす原因)が入りやすい。その治療は、皮膚バリア機能を保つための薬やスキンケア、痒みの原因(汗やほこりなど)を取り除くといった対症療法に加えて、ステロイド剤や免疫抑制剤が用いられているが、これらは炎症全般を抑える薬であり、痒みを根本から治す方法は見つかっていない。
※1 アトピー素因/①アトピー性皮膚炎、気管支喘息、アレルギー性鼻炎、結膜炎に罹ったことがある、または家族に罹った人がいる、あるいは、②IgE抗体(アレルゲンと結合してアレルギー反応を引き起こす物質)が作られやすい体質のこと。
解明されつつある「痒み」の謎
痒みは「弱い痛み」としてあまり研究されてこなかったが、実は痛みとは別のメカニズムであることが分かってきた。一つには、皮膚の細胞が作る「ヒスタミン」が痒みを引き起こすことが知られている。ヒスタミンを作用できなくする「抗ヒスタミン薬」は、痒みをコントロールするためにアトピー性皮膚炎の患者にも処方されるが、これが効かない患者も多い。
ヒスタミンではない痒み物質があるのではないかと言われる中で見つかったのが、「インターロイキン31(IL-31)」で、2004年、アトピー性皮膚炎の痒みを引き起こす物質として報告された。IL-31は、数ある免疫細胞の中で司令塔的存在の「ヘルパーT細胞」が作り出す。IL-31をブロックする薬ができれば、アトピー性皮膚炎の治療に新たな道を開くとして注目されている。
痒み物質「IL-31」と共に現れるタンパク質に着目
今年1月、福井教授の研究グループは、このIL-31産生の鍵となるタンパク質を特定した。IL-31を産生するヘルパーT細胞にGoサインを出すタンパク質があるという。遺伝学的アプローチによるマウス実験を見ていこう。
実験には、アトピー性皮膚炎を発症するマウス(モデルマウス)が必要だ。研究グループは、DOCK8(ドックエイト)という遺伝子を持たない人が重症のアトピー性皮膚炎を発症することに着目し、DOCK8を持たないマウスを作り、DOCK8を持つ野生型のマウスと同じ条件で飼育した。
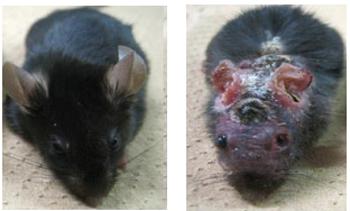
その結果、DOCK8欠損マウスのみアトピー性皮膚炎を発症したので、このマウスをモデルマウスとして、その血液を調べると、非常に高い値のIL-31が確認された。また、それに伴ってヘルパーT細胞内に現れたのが「EPAS1(イーパスワン)」というタンパク質だった。
EPAS1は、ARNT※2という分子と協調して作用し、酸素の少ない環境では、体を適応させるために血管や心臓の働きを高めることが知られている。だが、今回、これとは別の働きが、次の実験で明らかになった。
※2 ARNT/低酸素誘導因子の一つで、HIF-1βとしても知られる。体に酸素が不足すると作られるタンパク質。
「IL-31」産生のスイッチオフを実現
未知の物質の働きを知るために、その物質が作用できない状況を作って観察するやり方がある。研究チームは、アトピー性皮膚炎を起こすはずのDOCK8欠損マウスの遺伝子を操作し、EPAS1が本来の働き(つまり、発現)をしないようにした。すると、そのマウスはアトピー性皮膚炎を発症しなかった。

EPAS1が発現しないため、IL-31が作られなかったのだ。この現象は、アトピー性皮膚炎の患者から取り出したヘルパーT細胞でも再現された。そのメカニズムを詳細に調べると、意外なことが分かった。前述したように、本来EPAS1はARNTと協調して働くが、IL-31の産生にはARNTは必要でなく、別のSP1という分子が関与していた。
実験を通して、アトピー性皮膚炎になりやすくても、EPAS1が発現しなければ痒くならず、掻かなければ皮膚炎を起こさないという図式が見えてきた。
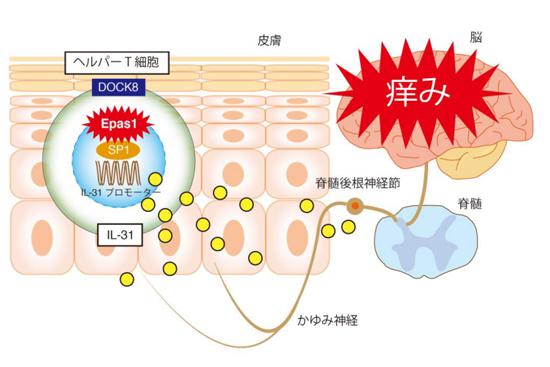
アトピー性皮膚炎の患者の皮膚にはヘルパーT細胞が多くある。その細胞質にあるEPAS1が核の中に入ってSP1と協調し、痒み物質「IL-31」(黄色丸)を作り出す。IL-31が脊髄後根神経節にある受容体にくっつくと、脳が“痒い”と認識する。DOCK8はEPAS1が核に入る(結果としてIL-31が作られる)のを抑える働きがある 提供:九州大学
新たな創薬ターゲット「EPAS1」
EPAS1を発現させない薬があれば、アトピー性皮膚炎は治るのではないか。そう考えた読者もいるだろう。しかしそれは「ベストな選択ではない」と研究グループの福井さんは言う。EPAS1の多彩な機能を全てブロックしてしまうからだ。ベストの選択は、“IL-31をつくる機能”だけを抑える薬。その薬は、EPAS1とARNTとの相互作用を妨げてもいけない。なぜなら、結果としてEPAS1の多彩な機能をブロックすることになるからだ。研究グループは、このような具体的なイメージを持って、目的の薬(化合物)の開発を目指している。
しかしそれは容易ではない。その化合物の同定には、まず 数十万の化合物をスクリーニングし、構造情報を基にヒット化合物(何らかの作用を示す化合物)の最適化を行う。最終的にリード化合物(新薬の候補)が得られたら、個体レベル(動物実験)で治療効果があるか、重篤な副作用がないかを確認する。そして初めて、臨床治験に進める。
福井さんたちは今、リード化合物の同定を目指して研究をスタートさせたところだ。同時に、「体がアレルゲンを認識してからEPAS1が活性化するまで」の経路においても、創薬ターゲットを探っていくそうだ。
「治る」日は来るのか?
「子どもの病気」のイメージが強いアトピー性皮膚炎だが、近年では大人の患者が急増し、新薬のニーズはますます高まっている。中には今回紹介したような基礎研究の成果が新薬開発に結びつき、現在臨床試験が行われている薬もある。「抗IL-31受容体抗体」はその一つで、“IL-31の作用を抑制する”ことで痒みを抑える。これに対し、福井さんら研究グループが目指すEPAS1阻害剤は、“IL-31の産生そのものをブロックする”方法だ。
このように、痒みを抑える機序が異なる薬が開発されていくのは、患者にとって治療の選択肢が増えることになり、大変望ましいこと、と福井さんは考えている。その上で、今回の成果の意義について次のように話してくれた。
「アトピー性皮膚炎の発症が乳幼児期に認められ、国民の7?15%に及ぶという状況ですから、抗IL-31受容体抗体といった生物製剤(高コストの注射製剤)を全ての患者さんに使用できる訳ではないでしょう。この点でも、痒みを根元から断つ低分子化合物の医薬品開発は意味があるように思います」
いつ薬が実用化するか、現時点では具体的に断言できないが、アトピー性皮膚炎は、症状と「つき合う」治療から「治す」治療を目指し、確実に前進している。近い将来、治療法の選択肢が多く提示されるようになり、患者やその家族が、大切な時間を痒みで苦しめられることのない日が1日でも早く訪れることを願う。
(サイエンスライター 丸山 恵)



