細胞内の物質輸送システムは、生命現象の根幹ともいえる。その重要な運び役を担いながらこれまであまりよく分かっていなかったタンパク質 「ダイニン」の、動く仕組みの一端が明らかにされた。今井洋(いまい ひろし) 中央大学理工学部助教、昆隆英(こん たかひで)大阪大学大学院理学研究科教授、島知弘(しま ともひろ)理化学研究所研究員(現東京大学大学院理学系研究科助教)らの研究グループは、低温電子顕微鏡法により、駆動中のダイニンの構造をとらえることに初めて成功した。
細胞内の宅配者
ダイニン(図1)と呼ばれる分子モーターは、私たちの細胞ひとつひとつに欠かせないタンパク質だ。 われわれの生活になくてはならない宅配便のように、細胞内で必要不可欠な輸送システムを担っている。核、ミトコンドリア、RNA、タンパク質といった配達物を必要な場所に、必要な量を常に運んでいる。事故や災害で物資輸送がストップすると大変なことになるように、細胞内のこの輸送システムに障害が起こると、脳神経疾病やガンなどの病気につながると考えられている。
細胞内で輸送を駆動する分子モーターは、「ダイニン」と「キネシン」の2種類がある。また、細胞内には、まるで道路のような「微小管」と呼ばれるタンパク質の管が張り巡らされていて、分子モーターは、その上を通って物質を運ぶ(図2)。ダイニンは細胞の中心方向へ、キネシンは細胞の周辺方向へと運ぶ役割分担があり、完璧ともいえる物質輸送システムが成り立っている。
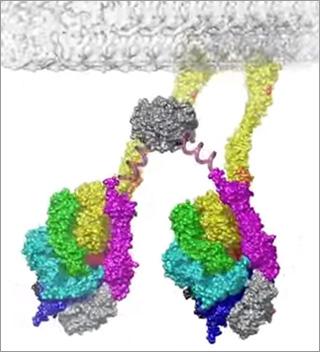
今、世界の研究者は、これら2種類の分子モーターの構造と動くメカニズムを、競って探求している。キネシンは研究が進み、2つのモーターが足となってまるで歩くように一歩一歩進むことが分かっている。だが、ダイニンは、2つのリング状のモーター(図1の6色から成る2つの円形部分)がつながった構造を持つことは分かっていたが、実際にどのように動くのかは長い間不明だった。微小管から離れた状態のダイニンのモーターについては、近年、本研究チームの昆氏らにより、X線解析による詳しい構造がようやく解明されたところだ。
そして、待望のダイニンの動く様子とは…

(出典:中央大学他、共同プレスリリース)
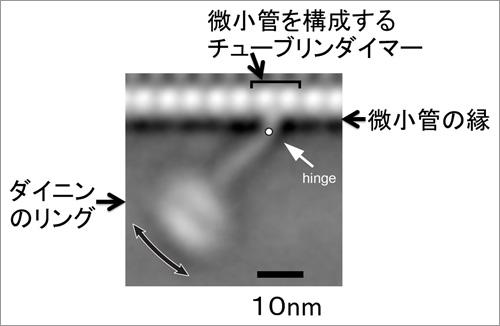
微小管につながるストークと呼ばれるヒモ状の部位に、リング状のモーターがぶら下がっている(図3)。その動きはまるでゆらゆらとウンテイをつたうようだ。また、微小管と結合する部分に蝶つがいのように可動するヒンジ(hinge)を持つことも初めて分かった(図4)。ダイニンがこのヒンジにより揺らぐ距離は、1回あたり最大で20ナノメートル※1。キネシンの一歩が8ナノメートルであるのに比べ、大きな動きといえる。
※ナノメートルは1マイクロメートル(μm)の1,000分の1、つまり、1ミリメートル(mm)の1,000,000(百万)分の1
観察にたどりつくまでの長い道のり
なぜこれが長年分からなかったのか。ダイニンの動く様子は顕微鏡をのぞけば簡単に分かるのでは?と思うかもしれない。確かに、分子モーターに蛍光分子を結合させて、その動きを光学顕微鏡で観察する方法がトレンドとしてあり、ダイニンの運動の軌跡をナノメートルの正確さで測定できる。しかし、蛍光分子がダイニン本来の動きを阻害する可能性がある上に、蛍光分子を観察してもダイニンの方向や形が見えないという懸念もある。
研究チームの今井氏はこう話している。「分子モーターは、それ自身が形を変えて前に進むものなので、その形の変化を捉えることが、分子モーターの動きの本質を理解することにつながります。しかし、これまで蛍光分子を用いた光学顕微鏡の観察でそれに成功した例はありませんでした。そこで、私たちは、蛍光分子を結合させることなく、直接分子モーターを電子顕微鏡で観察しました」
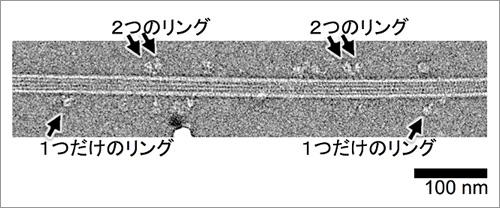
とは言っても電子顕微鏡は真空下で観察するので、ダイニンのような生体分子の生きた姿を観ることはできない。そこで研究チームは、「低温電子顕微鏡法」に着目した。試料を凍結してから観察する手法で、生体の本来の姿に近い状態を反映する。つまり、微小管上を動いているダイニンを瞬間的に凍結して観察するのだ。
しかし、どのような条件で急冷凍するかは経験と勘に頼るしかなく、冷凍方法の開発だけで2年の歳月がかかったという。さらに4年間の画像解析期間を経て、今回微小管上を動くダイニンがどちらを向き、どのように変化しながら動いているかを明らかにした。これを実現するには、1つや2つ観察するだけでは到底足りない。なんと10,000を超えるダイニンの観察写真を撮影した。それらを重ね、ダイニンが動く平均的な姿に画像処理を施しアニメーション化したのが上に紹介した成果なのだ。
さらなる基礎研究が必要
今回大きな進歩を遂げたダイニン研究だが、 実は観察できたのはダイニンのごく限られた領域のみである。その全長での機能や構造、結合する他のタンパク質の研究など、まだまだ基礎研究が必要だ。ダイニンが正常に機能するメカニズムが分かって初めて、次のステップである創薬に発展する。そのためには遺伝子工学を駆使して、疾患と関係のある変異体での構造や機能を解析することも重要だ。
しかしその道のりは長そうだ。今井氏と昆氏はこう語る。「ダイニンの研究の難しさは、ダイニンが巨大で複雑なタンパク質であることによります。そのため遺伝子工学が非常に難しく、タンパク質の遺伝子操作や発現精製は、世界でもごく少数の限られた研究室でしか実現できていません※2」 遺伝子組み換え体を大量に調整し、構造を高分解能で解析するプロセスは、タンパク質が巨大になるほど時間がかかり、反応のミスも起こりやすい。発現精製には高い技術が求められ、誰もができるような簡単な実験ではないという。
※2 タンパク質の発現精製/生体内でわずかにしか存在しないタンパク質の構造解析や機能解析を行うために、目的のタンパク質を、その遺伝子(DNA)配列あるいはアミノ酸配列から、遺伝子組み換えの手法を用いて宿主細胞に生産させ、分離・精製する技術。
今井氏によれば、通常の小さな分子の発現精製は数週間で可能だが、ダイニンのような大きな分子の場合、数カ月で1回と長い時間を要し、専用の装置も必要になるという。数回の実験を繰り返すと、それだけでも半年がかりの仕事となるそうだ。
分子モーターの研究は、日本、アメリカ、イギリスで盛んに行われ、日本は世界で最先端を競っている。今後、遺伝子工学の専門家も含む本研究チームが、世界をリードしていくだろう。
難病治療への期待
現在、キネシンをターゲットにしたがん治療薬の開発が進んでいる。細胞分裂に関わるキネシンを阻害する薬で、日本でも開発が始まりアメリカでは臨床試験段階にある。
一方、ダイニンは、ヒトのがん細胞や神経細胞の発達・維持に関わる病気との関連は分かっているが、まだ具体的な治療薬を開発するレベルに達していない。ダイニンのように生命に必須なタンパク質をターゲットとした創薬は開発が非常に難しいが、その貢献は著しいだろう。
「現在、キネシンの研究が創薬に活かされているのは、多くの研究者の努力の賜物です」と語る今井氏。まだまだ調べることが山のようにたくさんあると意気込む研究チームに、今後の成果を期待したい。
なお、本成果について、以下の映像ではダイニンの構造や動きが分かりやすく紹介されているので、ぜひご覧いただきたい。
映像1.英国国立リーズ大学が作成した解説映像「細胞内を移動するタンパク質『ダイニン』が動いているときの構造が見えた!-細胞内の物質輸送を行う分子モーターが動く仕組みの解明へ-」
(サイエンスライター 丸山 恵)



