何にでも強力にくっつく微生物「アシネトバクター」の接着力の正体が見え始めた。堀克敏(ほり かつとし)名古屋大学大学院工学研究科生物機能工学分野教授は、アシネトバクターから生える毛のようなタンパク質の一部を解析し、三つ編み状の強くてしなやかな立体構造を発見した。これが強力な接着力に重要な役割を持つという。この発見は、バイオテクノロジーの分野でどんな意味があるのだろうか。
近年、生き物の機能や性質を生かしたバイオテクノロジーが注目されている。中でも微生物は、バイオ燃料や環境浄化の分野で期待の星だ。しかし、活用に至るまでの生産プロセスは高価であり、低コスト化が求められている。そこで、微生物の表層が持つ優れた機能でこの課題を克服しようとしているのが堀氏だ。微生物が持つ「くっつく」性質がいったい何の役に立つのか?私たちの想像を超える微生物の可能性に迫る。
簡単ではない、微生物の産業利用
「微生物」といえば「発酵」を連想する人も多いだろう。発酵には、微生物の持つ酵素が欠かせない。酒やみそ、堆肥など、微生物は古くから私たちの生活を支えてきた。酵素は、最近では環境にやさしい産業に応用されている。その一例がバイオ燃料だ。トウモロコシなどの植物資源を、微生物の酵素を触媒にしてアルコール発酵させるとエタノールができる。これを燃料として(アルコールランプを思い出してほしい)産業に利用するのだ。
人工的な触媒は高温・高圧状態でないと反応が進まないのに対し、酵素のような生体触媒は常温・常圧で反応が進む。生態系の土台を支える微生物は、偉大なる縁の下の力持ちだ。
しかし、産業に利用するには多くの技術的課題がある。酒やみその製造を想像しても分かるように、微生物の反応には時間がかかる。それなのに、生産量は人工的な物質を化学反応させたものと比べて桁違いに低い。また設備や副生物の精製などで、コストがかかる。
低コスト化の戦略のひとつが、「微生物の固定化」だ。本来、微生物は、水中でバラバラに散らばった状態で働いている。それをまとめて何かにくっつけて固定し、反応させるのだ。これにより、微生物が作りだす生成物が回収しやすくなり、微生物には何度も繰り返し働いてもらえる。これまでは、ゲル状の高分子に微生物を包んで固定する方法がよく使われていたが、ゲルから微生物が漏れ出したり、ゲルの内部に反応物質が届きにくかったりして、実用的ではなかった。
微生物の「接着力」で解決することとは?
そこで新しい固定法の開発の糸口となったのが、堀氏らが2001年に見つけたアシネトバクターという微生物(バクテリア)だった。細菌の一種で、他に例を見ない接着力を持つ。面白いことに、金属やプラスチック、ガラスなど、何にでもくっついた。

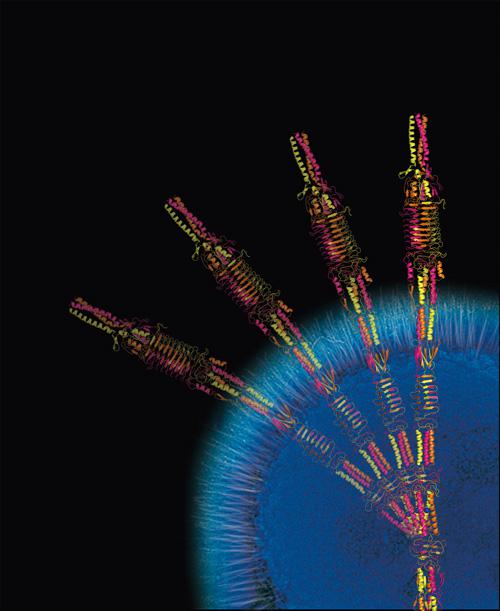
調べていくと、この接着の正体は、アシネトバクターの表面に生える毛だった。長さ250ナノメートル、3630ものアミノ酸からなる細菌ナノファイバータンパク質である。堀氏はこのナノファイバーを、「AtaA」と名付けた。AtaAは、Acinetobacter Trimeric Autotransporter Adhesinの略で、アシネトバクターの三量体自己輸送型接着タンパク質を意味する。
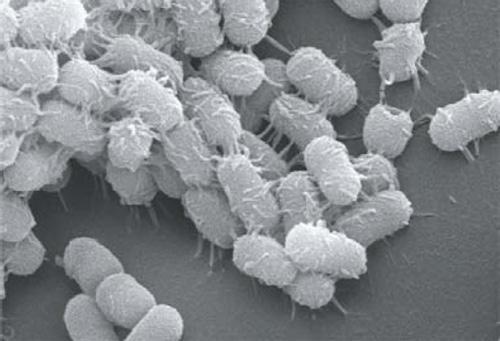
堀氏らはAtaAの遺伝子を同定し、くっつく性質を持たない別のバクテリアにこの遺伝子を導入した。するとそのバクテリアにAtaAが生え、どんなものにもくっつくようになったのだ。微生物自身がくっついてほしいものにくっついてくれれば、もうゲルに包む必要はない。そこで、この性質を利用してより実用性の高い固定化技術を確立し、特許も取得した。
なぜそんなに強くくっつくのか?
次に、堀氏らはAtaAの構造に着目した。しかし、タンパク質の構造を調べるのは容易ではない。X線を当てて解析するためには、まず分子が規則正しく並んだ質のいい"タンパク質の結晶"を作らなければいけない。堀氏らは、この分野でトップのドイツのマックスプランク研究所と共同研究し、AtaAの一部を結晶化することに成功した。そして、X線結晶構造解析という特殊な方法で、その3次元構造を明らかにした。これがその姿だ。
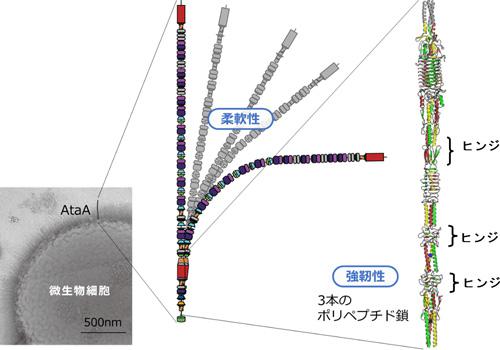
注目したいのは、「ポリペプチド」というアミノ酸がたくさんつながった鎖の三つ編み構造だ。一見、有刺鉄線のようにも見える3本のポリペプチドは、物理的にも化学的にも非常に強く結びついており、簡単には壊れない。その上、所々にヒンジのように曲がる構造もあり、柔らかさも兼ねそろえている。研究グループは、AtaAの強力な接着力の秘密が、この強くてしなやかな構造にあると見ている。
研究が広げる、微生物の果てしない可能性
AtaAの立体構造が見え始めたことで、堀氏が開発した微生物固定法の向上はもちろん、意外にも院内感染の予防にもつながるかもしれない。というのは、院内感染などの原因菌として現代社会で大変恐れられている薬剤耐性菌は、アシネトバクターの仲間であり、堀氏らが今回発見したのと同じ立体構造を持っている。くっつく構造がより詳しく解明されて人にくっつく(つまり感染する)仕組みが分かれば、効果的な感染予防策が期待できるのだ。
研究の次のステップは、いろいろな微生物に接着性ナノファイバーを生やし、固定化微生物に適した新しいバイオリアクター注1を設計することだ。しかし現状では、AtaAを生やして接着機能を発揮させることができる微生物の種類が限られている。巨大な膜タンパク質であるAtaAは、多数の複雑なドメイン注2が反復して並びながらホモ三量体注3を形成するが、このような巨大で複雑な構造を持つタンパク質を細胞の表層に分泌させ、正しい立体構造を取らせることは、非常に難しいのだという。
- 注1 バイオリアクター/酵素などの生体触媒を使って生化学反応を行う装置。
- 注2 ドメイン/ここではタンパク質ドメインのこと。タンパク質が機能を果たすための最小構造単位。
- 注3 ホモ三量体/同一のタンパク質(または高分子)が3つ結合した複合体。
そこで、今、堀氏らは、AtaAの接着機能を保ちながら縮小することと、AtaAタンパク質の分泌・立体構造形成メカニズムの解明に取り組んでいる。後者は、病原菌の感染メカニズムの解明にも直結する、非常にホットで世界の研究者達が注目しているテーマだ。
堀氏は「微生物工学の新しい時代を切り開きたい」と語る。野望は、新しい固定化微生物に適した新発想のバイオリアクターを創造し、合成生物学も融合することで微生物の適用範囲を化学工業に大きく拡げ、廃棄物処理を効率化し、温暖化を含む地球環境問題の解決に大きく貢献することだという。
この研究によって微生物の未知なる潜在力を最大限に引き出すことができれば、堀氏が自身のミッションとして掲げる「地球環境保全」「人類の幸福」「世界平和」への貢献は、決して大げさな目標ではないのかもしれない。微生物研究のこれからに注目だ。
*写真および図版提供:名古屋大学 堀 克敏氏
サイエンスライター 丸山 恵




