タンパク質の構造解析で画期的な技術が登場した。微小で薄いタンパク質結晶の構造を電子線で解析する新しい技術を、理化学研究所(理研)放射光科学総合研究センターの米倉功治(よねくら こうじ)准主任研究員と東京大学分子細胞生物学研究所の豊島近(とよしま ちかし)教授らが開発した。この新技術を膜タンパク質などの薄い結晶に適用して、アミノ酸やイオンの荷電状態の可視化に成功した。複雑な生体分子の構造解析を発展させる技術として注目される。日立ハイテクフィールディング、日立ハイテクノロジーズとの共同研究で、2月17日付の米科学アカデミー紀要オンライン版に発表した。
タンパク質の機能を知るには立体構造の解明が欠かせない。その結晶を作成し、SPring-8などの放射光施設でX線回折を行うことが構造決定の一般的な手順になっている。しかし、構造が複雑な膜タンパク質や生体超分子複合体の結晶を作ることは難しく、微小な結晶や数層の重なりにとどまる結晶しか得られないことが多い。これらの結晶は、X線回折測定には小さくて薄すぎる。一方、電子線はX線よりも10万倍も強く、試料に散乱されるため、結晶性が良ければ、微小で薄い結晶からでも、高い空間分解能で回折点を観測できる。
研究グループは、微小で薄い結晶の構造を決める電子線結晶構造解析の技術開発に挑戦した。電子線は負の電荷を持つため、同じ原子でも、電荷を持ったものと中性のもので、散乱のされ方は大きく異なる。電子線結晶構造解析では、この電荷分布の情報を含む分子の電位の分布である3次元静電ポテンシャルマップが得られる。タンパク質などの生体分子が機能を発揮するのに、アミノ酸や金属イオンの荷電情報は非常に重要だが、X線回折からは取得できず、電子線でそれが可能となる。
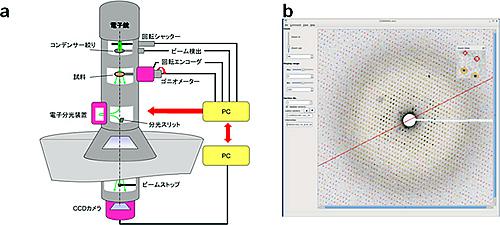
共同研究グループは、日立ハイテクノロジーズの電子顕微鏡をベースに、電子線回折測定用に新しい電子回折計を開発した。このシステムは、回転角度を高精度に制御できる試料台を備え、結晶を回転させながら電子線回折パターンを記録し、回折点の正確な強度情報を取得できる。また、搭載した電子分光装置で、試料に弾性散乱された電子を選択して結像できるようにした。同時に、電子線回折パターンを処理する最適なソフトウエアも開発した。
開発したこのシステムで、筋小胞体にある膜タンパク質ウサギ筋小胞体Ca2+-ATPaseと、牛肝臓カタラーゼのごく薄い結晶の構造を解析した。これらのタンパク質の静電ポテンシャルマップを取得し、機能部位のアミノ酸や金属イオンの荷電情報を可視化した。Ca2+-ATPaseの膜内部位にあるCa2+結合部位の荷電情報は理論計算の結果とよく一致した。膜貫通部位の酸性アミノ酸にプロトン(水素イオン)が付加していることもわかった。
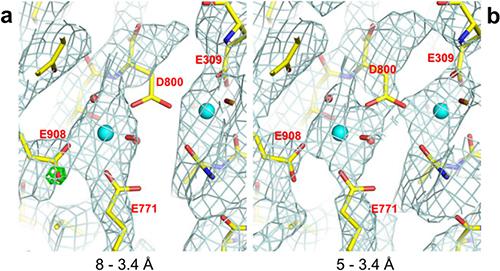
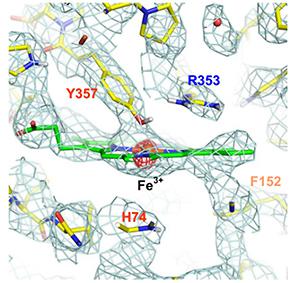
水溶性の超分子複合体で、有害な過酸化水素を分解するカタラーゼについては、8?〜3.2?分解能の電子線回折を基に計算した静電ポテンシャルマップから、その酵素活性部位にあるヘム(鉄ポルフィリン錯体)の鉄の荷電状態の情報がつかめた。
また、この2つのタンパク質のすべてのアミノ酸の静電ポテンシャルマップを統計的に処理したところ、8?までの低分解能の情報を含んだ場合、アスパラギン酸とグルタミン酸の側鎖の密度が減少する傾向が明らかになった。
米倉功治・准主任研究員は「この電子線構造解析システムがアミノ酸やイオンの荷電状態を解析する汎用性の高いツールになることを示せた。X線構造解析では利用できなかった微小で薄い結晶での構造決定や、荷電状態の可視化に威力を発揮するだろう。生体分子のより詳細な作動の仕組み解明につながり、生命科学の発展、新たな治療法や薬の開発、工学への応用などに寄与が期待できる」と次代の構造生命科学への展望を話している。
関連リンク



