ビタミンやミネラルのサプリメントが簡単に手に入るようになった今、貧血の予防に鉄分サプリメントをとる人も多いだろう。一般に、血液の材料である鉄が不足すると貧血(鉄欠乏性貧血)が起こると言われるが、体の中の変化はもっと複雑のようだ。東北大学大学院医学系研究科の研究チームは、九州大学生体防御医学研究所との共同研究で、体に鉄が不足すると、血液の細胞がつくられる初期の段階で、遺伝子の発現※1に変化が起きることを明らかにした。さらに、鉄不足の状態に体を対応させる物質「Bach1」も特定した。新たな治療にもつながりそうな鉄欠乏性貧血の側面が見えてきた。
※1 遺伝子の発現/DNAの書き込まれている遺伝情報から、さまざまな生態機能をもつタンパク質をつくり出す過程
貧血の診断基準「赤血球」と「ヘモグロビン」
貧血とは、「赤血球」と「ヘモグロビン(血色素)」が正常の値より少なくなった状態をいう。赤血球もヘモグロビンも、健康診断で血液検査を受けると結果の表にほぼ必ず含まれる項目なので、聞き覚えがあるだろう。
赤血球はヒトの体で最も多い細胞で、全細胞の約7割の25兆個を占め、1日に約2,000億個が新たにつくられている。赤血球の組成の約3分の2は水分で、残りのほとんどはヘモグロビンである。ヘモグロビンは、鉄を含む色素成分「ヘム」と、「グロビン」というポリペプチド※2から成るタンパク質。この「ヘム」が酸素分子と結合し、血流にのって全身に酸素を運ぶ。
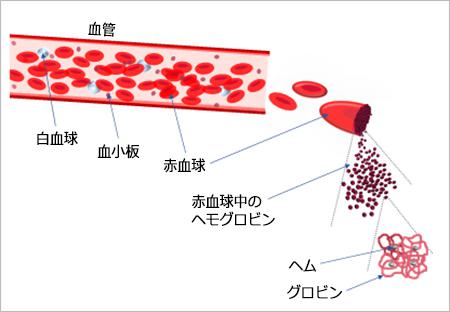
※2 ポリペプチド/10個以上のアミノ酸が鎖のように結合したもの。
鉄欠乏性貧血とヘモグロビン減少のしくみ
貧血と一口に言っても、原因により、いくつか種類がある。最も頻度が高いのが鉄欠乏性貧血だ。この患者の赤血球の数は、正常であることも多いが、ヘモグロビンが減り、酸素を全身に運ぶ能力が落ちる。その結果、疲れや動悸などの症状で日常生活に支障をきたすこともある。日本での罹患は若い女性に多く、若い女性の10人に1人は貧血と言われている。また、悪性腫瘍や潰瘍性大腸炎など慢性的な出血も原因になる。
では、出血しても血液はどんどんつくられるのに、なぜヘモグロビンは減ってしまうのか?その背景には、鉄代謝のしくみがある。赤血球が約120日の寿命を迎え、分解されてつくり変えられるとき、含まれていた鉄は新しいヘモグロビンの材料として再利用される。奇しくも鉄は、他の栄養素に比べ吸収率が悪く、食事からの供給はごくわずかなので、血液を失い再利用する鉄が少ないと、新しくつくられるヘモグロビンが減ってしまうのだ。
ヘモグロビンの合成について、もう少し掘り下げてみよう。ヘモグロビンは、別々の経路でつくられたヘムとグロビンから合成される。このとき、ヘムの合成に必要な鉄が少ないと、ヘムの合成量が減り、面白いことにグロビンは、ヘムの量に見合った量がつくられる。くっつく相手(ヘム)がいないグロビンは酸化されやすく、体にとって有害な物質になるため、制御されるのだ。私たちの体には、そのように、ヘムとグロビンのバランスをとる素晴らしいシステムが備わっている。
研究チームは、遺伝学的アプローチを駆使し、このシステムの中心的役割を担う物質「Bach1(バックワン)」を特定した。
ヘムとグロビンのバランスをつかさどる「Bach1」に迫る
Bach1は、転写因子と呼ばれるタンパク質だ。転写とは、遺伝情報からタンパク質をつくる最初のステップで、DNAから必要な情報だけをRNAにコピーする過程をいう。Bach1のような転写因子は、転写が早く進むよう促したり、逆に進まないように抑え止めたりする。
Bach1はもともと、ヘムを分解する酵素(ヘムオキシゲナーゼ)、あるいはグロビンなどの遺伝子の転写抑制因子(転写を抑える転写因子)として知られており、ヘムとグロビンの合成に関わると考えられていた。しかし、Bach1を遺伝的に持たないマウスに血液の異常があるかというと、そうでもない。そこで研究チームは、体が鉄不足のときだけBach1が働くのではないかと仮説を立て、実験を行なった。
鉄欠乏状態のマウスで、遺伝子発現の変化とBach1の働きを観察
実験は、研究チームが独自につくり出した、重篤な鉄欠乏性貧血を再現性よく発症するモデルマウスで行われた。まず、モデルマウスの赤芽球(赤血球のもとの細胞)の遺伝子解析を行った結果、鉄欠乏性貧血はヘモグロビンの減少だけでなく、遺伝子の発現までも変えていることが見えてきた。具体的に観察されたのは、広範囲に渡るDNAメチル化※3の変化で、DNA上のあちらこちらで、本来働くはずの遺伝子が働かなくなっていた。
さらに、Bach1を遺伝的に持たないマウスを作製し、Bach1を持つマウスと比較すると、先述の「鉄不足」と「Bach1」の関係についての仮説を裏付ける結果が得られた。
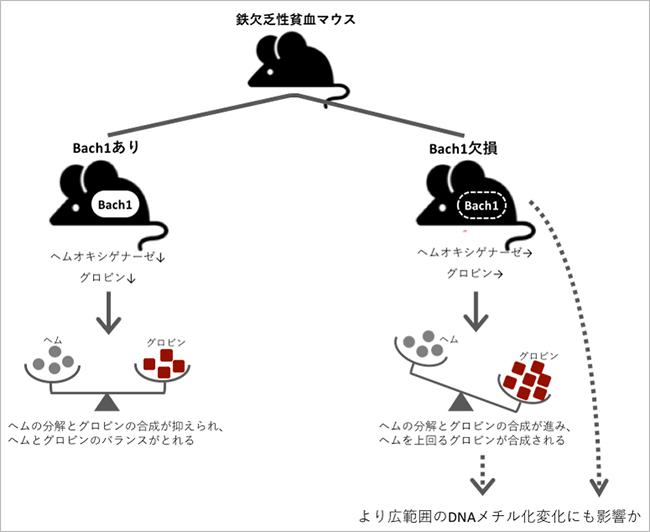
Bach1を持つマウスは、鉄が欠乏した状態でヘムの合成量が減ると、グロビンがつくられる量を減少させたり、これ以上ヘムが分解されないように分解酵素の働きを抑えたりして、ヘムとグロビンのバランスが崩れることはなかった。しかし、Bach1を持たないマウスの場合、そのようなバランス調節は行われず、グロビンが過多となり体は危険な状態に陥ってしまった。Bach1は、鉄欠乏のときだけその機能を発揮していたのだ。
また、Bach1を持たないマウスに、より広範囲のDNAがメチル化する変化が起こっていた。Bach1が直接的に、あるいはグロビンの増加による酸化ストレス等の影響で間接的に、DNAメチル化に影響している可能性も考えられるという。
※3 DNAメチル化/ DNA上で、遺伝子を使うか否かを制御している部分にメチル基(−CH3)が付く反応。メチル基が付くと遺伝子の発現が抑制され、その遺伝子は機能できなくなってしまう。
新しい診断法や治療法につながる可能性も
今回マウスで得られた実験結果は、どこまでヒトに応用できるのだろうか。興味深いことに、ヒトもマウスも正常なヘモグロビン濃度は13〜15 g/dlと非常に似通っているという。研究チームは、今回の実験でのマウスの鉄欠乏の度合い(ヘモグロビン濃度5 g/dl前後)は、実際にヒトでも起こりうるが、ヒトの鉄欠乏時に“DNAメチル化”に変化があるか、あるいは“Bach1のヘム/グロビンバランスの調節機能”が働くかどうかを確かめるためには、ヒトでの研究が必要だという。
しかしながら今回の結果は、鉄欠乏性貧血の診断や治療の道を拓く可能性を秘めている。例えば、重症になりやすい患者や、鉄剤を飲んでも改善しない患者の中には、Bach1の遺伝子変異や機能低下が関わっている可能性がある。そのような患者のBach1を解析すれば、正確な診断や適切な治療法の選択ができるようになるかもしれない。研究チームは今後、さまざまなモデルマウスや次世代シークエンス技術などを用いた網羅的解析により、今回の結果についてさらに理解を深め、新たな貧血治療法の開発につなげていくという。
立ちはだかる壁“赤血球造血の謎”
ヒトの体を構成する最多の細胞であり、日々莫大な数がつくられる赤血球は、一生涯の産生数でもダントツ一位だ。旺盛な赤血球の造血がどうやって維持されるかは、未知の部分がまだ多い。研究チームを率いる五十嵐 和彦(いがらし かずひこ)東北大学大学院教授は、赤血球の進化に触れ、「原始的な血液細胞は、マクロファージ(貪食細胞)とされています。その分化経路を変えて赤血球という細胞を大量につくるようになったことは、本当に不思議で驚きです」と、謎めいた赤血球について話す。そして今回のような研究成果を臨床への応用につなげるためには、「赤血球造血が鉄欠乏によりどう破綻していくのか、その分子機構を理解する必要がある」という。
おわりに
鉄欠乏性貧血は日本だけでなく、世界でも深刻な問題のひとつだ。特に、発展途上国には、鉄の摂取源に乏しい地域も多い。現在、多くの国々で行われている鉄欠乏性貧血の予防や治療は、鉄を含む食品やサプリメントの摂取、経口または注射による鉄剤の投与による。しかし、ここで紹介した成果のように遺伝子レベルで病態が解明されれば、赤血球やヘモグロビン以外の診断基準や、患者個人に応じた予防法や治療法が見出されていくだろう。社会問題としての鉄欠乏性貧血の改善にも、ぜひつながってほしい。
(サイエンスライター 丸山 恵)



